
|
ICH M9将协调基于BCS的BE豁免
2016.10.21
2016年10月,ICH公布了M9基于生物药剂学分类系统的生物等效性试验豁免(Biopharmaceutics Classification System-based Biowaivers)的概念文件和业务计划。仿制药能否申请生物等效性试验豁免,是非常重要的内容。M9刚刚进入第一步(Step 1),值得期待。下文是M9概念文件内容的中文...
|

|
FDA发布针对两个专注达仿制药的撤市听证会通知
2016.10.18
10月17日,FDA通过两份联邦公报(FR)通告分别宣布两家公司的盐酸哌甲酯缓释片撤市听证会通知(NOOH, Notice of Opportunity for Hearing)【FR通告一
所有这些都发生在近两年前,现在FDA正在启动最后的行政措施以永久性的从市场上撤回这两个产品。
识林相关资讯
2015-08-19...
|
|
FDA具体产品生物等效性指南修订后的思考
2016.10.05
10月4日美国FDA发布67份具体产品生物等效性(BE)指南,其中34份新增33份修订,这是今年第三次批量发布和更新BE指南。FDA一直忙于放出新的BE指南和修订过去的指南文件。根据GDUFA II的新规定,仿制药办公室(OGD)将设定目标在最早合法批准日期至少两年之前针对90%的产品发布具体产品BE...
|
|
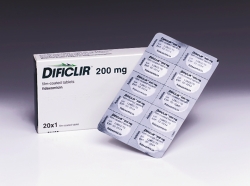
FDA发布非达霉素片剂BE指南并回应原研商请愿
2016.08.29
美国FDA于2011年5月批准Cubist制药公司的Dificid(非达霉素)200mg片剂,如万古霉素一样,用于治疗艰难梭菌相关的腹泻。两种药物均全身吸收差,治疗消化道和肠道局部病症。但是,万古霉素在生理学相关的溶出介质范围内比非达霉素更可溶。非达霉素的原研商Cubist于2015年5月7日提交了一份...
|
|
半年之内FDA再次修订帕利哌酮长效注射剂BE指南
2016.07.05
我们之前曾报道过FDA于2015年12月发布对用于肌肉注射的棕榈酸帕利哌酮长效注射剂混悬液生物等效性指南(BE)的修订【识林资讯-FDA修订帕利哌酮长效注射剂BE指南】。FDA于今年6月又发布了另一修订版本(2016年6月修订版草案)。
我们注意到有一些有趣的变化。之前我们介绍过2015年12...
|

|
依维莫司片两个不同BE指南的警示
2016.07.04
2016年6月最近更新的具体产品的生物等效性(BE)指南中,有一篇关于依维莫司(Everolimus)的BE指南(RLD 021560),该指南涵盖了治疗器官排斥反应中的药物使用。之前的指南文件(2011年3月首次发布,2012年6月修订)适用于肿瘤适应症的不同产品(RLD 022334)。
两个指南文件都提...
|

|
美国会议员寻求阻止制药商阻碍仿制药竞争
2016.06.19
在不到两年的时间内,美国国会议员第三次提出旨在结束仿制药生产商指控的品牌药品竞争对手用于阻挠竞争做法的法案。
品牌药生产商有时拒绝向仿制药公司提供样品,在这样的做法遭到不断投诉之际,由民主、共和两党联合提出的这一名为《创建和重建公平获取等效样品法案》)用于仿制药。为...
|
|
FDA对异丙酚注射剂的新BE要求
2016.06.19
6月16日FDA新发布19种药品的生物等效性(BE)指南,同时修订了另外19种药品的BE指南,其中一篇关于异丙酚注射剂的新发布BE指南引人关注。
所关注的问题涉及对产品配方定量(Q1)和定性(Q2)相同超出过去要求的新规定。对于大多数非肠道产品,只要申请人“鉴别和表征出存在的差异,并提...
|

|
CREATES议案能否帮助仿制药企业获得所需参照样品
2016.06.18
美国参议院司法委员会于6月14日提出《2016创建和重建公平获取等效样品法案(CREATES)》,旨在阻止对受限制的分销系统和风险评估与减轻策略(REMS)计划的滥用。这两个手段会如何阻碍可负担得起的仿制药的市场准入?
品牌药公司拒绝将产品样品销售给潜在的仿制药竞争者,从而使得仿制药...
|

|
FDA李冰博士访谈:局部作用鼻喷剂BE评价的新兴技术
2016.05.24
翻译自“FDA/CDER SBIA CHRONICLES”5月19日"FDA Embraces Emerging Technology for Bioequivalence Evaluation of Locally Acting Nasal Sprays“
采访人:Renu Lal博士
受访人:李冰博士
校译:识林-Kapok
FDA积极采用局部作用鼻喷剂生物等效性评价...
|

|
FDA具体BE指南修订给企业带来的难题
2016.05.13
随着时间的推移,我们都看到了FDA ANDA生物等效性(BE)指南文件草案或终稿形式的多种版本。在某些情况下,FDA做出相对较小的变化,但是在另外一些情况下,FDA会要求在数据收集、指标,有时候在研究设计方面要求重大修订。例如,FDA可能要求之前没有要求的进食研究。有时,FDA修订BE指南...
|

|
EMA开始审查基于印度CRO Semler研究的药品
2016.04.29
欧洲药品管理局(EMA)周五宣布,最近在印度班加罗尔工厂的检查发现严重数据可靠性违规后,正在审查依赖合同研究机构(CRO)Semler研究公司开展研究的所有欧盟授权药品。
EMA表示是基于最近来自美国FDA和世界卫生组织(WHO)的通知中提出的问题而开展的审查。据EMA表示,依赖于Semler开...
|

|
FDA严处印度临床研究机构Semler
2016.04.22
编者按:FDA彻底调查了这家公司以前开展的研究,上市的品种目前均未发现安全性问题。但FDA依然做出如此严重的处罚,主要是做事方法不合规矩,尽管之前根据其所开展的研究数据支持获批的药品并没有发现安全性问题。这件事对我们的企业提供了一定参考,如果被FDA发现企业做事不当或存在数...
|

|
FDA发布38份新BE指南和6份修订指南
2016.04.16
FDA仿制药办公室正以不断的努力保持满足行业获取关于建立仿制药产品生物等效性指南的愿望。4月14日,FDA发布38个药品的新BE指南,6份修订指南(见BE指南更新)。在新发布指南文件中有一些建议,修订指南中有一些有趣的问题,如下所述。
格拉默 Glatiramer
在花费超过7年批准一例盐酸...
|

|
FDA修订拉莫三嗪缓释片BE指南
2016.01.30
1月28日FDA发布47篇具体产品建议(35篇新发布,12篇修订),概述了FDA关于如何研发与特定参照药品治疗等效的仿制药的当前想法和期望,以帮助仿制药企业确定最为合适的方法研发药品和产生支持ANDA批准所需的证据。
其中关于拉莫三嗪(Lamotrigine,苯三嗪类的广谱抗癫痫和抗躁郁症药物)E...
|
|
在美国的临床研究都需经过IND申请吗?
2015.11.04
编者按:
FDA的IND不是备案制,尤其是对于新靶点、新分子的IND,FDA会很严格的审评,还可以经过IND之前的会议来沟通;报IND最大的好处是,把临床中的风险报告给药监局,这样企业和药监局共同做研究,而不是出事之后再处理,药监局还可以帮助企业做判断。
临床研究想支持NDA...
|

|
借助体外溶出方法开展一致性评价的思考框架
2015.09.15
借助体外溶出方法开展一致性评价已有很多讨论。本文是对这一话题讨论思路和分析框架的探索,将分别从科学层面和决策层面展开。
p1=科学层面
科学层面解决的核心问题是如何为每个药品找到具有区分力又不过于敏感的体外溶出方法(以下称“体外方法”),并评价体外方法预测BE(Bio-Equi...
|

|
FDA更改多动症治疗药品的BE要求后续
2015.08.19
案件1:FDA在降低专注达ANDA产品治疗等效性评级挑战中占优势,但是被上诉了
2014年11月,FDA将Mallinckrodt的专注达(哌甲酯盐酸盐)缓释片剂仿制药产品的治疗等效性(TE, therapeutic equivalence)评级从AB变更为BX。2015年7月29日,马里兰地区法院宣布了对Mallinckrodt诉讼FDA一...
|

|
速释固体口服制剂溶出度检测新观点
2015.08.02
FDA日前发布了一份名为《含有BCS I类与III类药物的速释口服固体制剂的溶出度试验与质量标准》的指南草案,这与稍早前同样针对速释口服固体制剂所发布的有关生物等效性试验豁免的指南草案不无联系。
BCS I类与III类是基于药品在生理pH范围内有较高的溶解度而定义的,如果设计成传统的...
|

|
由临床试验数据自查想到
2015.07.24
国家食品药品监督管理总局于7月22日发布了《关于开展药物临床试验数据自查核查工作的公告》(2015年第117号),简称“117号文”,给炎炎盛夏中平增了几分热度,被誉为今夏医药产业界最大的热门话题恐怕丝毫也不为过。各种解读、各种传闻一时间充斥着朋友圈,无论如何,以“最严谨的标准、...
|