
|
巴西低成本 CAR-T 计划,拟向民众免费提供
2024.03.29
嵌合抗原受体(CAR)T 细胞疗法的疗效不断被证明,但其高昂的价格令中低收入国家和地区的患者望而却步,目前 CAR-T 在美国的治疗费用在 37 万至 53 万美元之间,其中大部分是生产成本。之前我们介绍了印度本土生物技术公司实现了以全球同类商业化产品十分之一的成本生产 CAR-T ...
|

|
印度产 CAR-T 疗法实现降本增效,成为中低收入国家...
2024.03.25
印度孟买一家小型生物技术公司 ImmunoACT 正在生产尖端癌症治疗药 — 嵌合抗原受体(CAR)T细胞疗法的本土版本。CAR-T 产品目前主要用于血癌,在过去几年中蓬勃发展,而印度产 CAR-T 疗法成本仅为全球同类商业产品的十分之一。
+截至目前,中、美、欧获批上市的 CAR-T ...
|
|
FDA 专家会支持强生传奇生物的Carvykti和BMS的Abecma...
2024.03.18
美国 FDA 肿瘤药专家会(ODAC)于 3 月 15 日对两款 BCMA 靶向 CAR-T 疗法 Carvykti(强生/传奇生物)和 Abecma(BMS)的讨论和投票结果已经出来,虽然两款药在各自的试验中显示出患者早期死亡的潜在问题,但专家们仍然认为这两个药的长期获益大于风险。
11名专家一致投票支持 ...
|

|
FDA 关注强生传奇以及BMS两款CAR-T骨髓瘤试验中的早...
2024.03.14
美国 FDA 将于 3 月 15 日召开肿瘤药专家会(ODAC)讨论两款 CAR-T 疗法研究的早期患者生存率的负面趋势“在临床获益的背景下是否可以接受”。
根据 FDA 为专家会准备的简报文件,FDA 对两项旨在将 CAR-T 疗法 Carvykti(强生/传奇生物)和 Abecma(BMS) 纳入多发...
|

|
FDA 将对两款 CAR-T 疗法召开专家会,行业聚焦对...
2024.02.23
美国 FDA 将于 3 月 15 日召开肿瘤药物专家委员会(ODAC)全天会议,审查两款用于早期治疗多发性骨髓瘤的 CAR-T 治疗药 —— 百时美施贵宝(BMS)和 2seventy bio 的 Abecma 以及强生和传奇生物的 Carvykti。
届时 FDA 邀请的外部专家将审查 Carvykti 的 CARTITUDE-4 试验和...
|

|
FDA 批准首个实体瘤个体化 T 细胞疗法
2024.02.19
美国 FDA 于 2 月 16 日加速批准了 Iovance 生物治疗公司的 liucel(Amtagvi),一种肿瘤源性自体 T 细胞免疫疗法,用于治疗先前接受过 PD-1 阻断抗体治疗的不可切除或转移性黑色素瘤成年患者,。
该药是第一个进入市场的个体化肿瘤浸润淋巴细胞(TIL)疗法。这标志着...
|

|
FDA 定稿CAR-T细胞治疗的研发考量指南
2024.01.31
美国 FDA 于 1 月 29 日发布了《嵌合抗原受体(CAR)T 细胞产品的研发考量》定稿指南,提供了有关化学、生产和控制(CMC)、药理学和毒理学以及肿瘤适应症(包括血液恶性肿瘤和实体瘤)临床研究设计的 CAR-T 细胞具体建议。
指南中注明了针对自体或同种异体 CAR-T 细胞产...
|
|
FDA 对所有 CAR-T 疗法添加继发性癌症黑框警告
2024.01.24
美国 FDA 已通知诺华、吉利德、百时美施贵宝和强生公司在六种 CAR-T 治疗药的标签上添加黑框警告,指出继发性癌症风险。
FDA 在去年 11 月份公布正在调查 CAR-T 治疗后发生 T 细胞恶性肿瘤的严重风险时,在 CAR-T 领域引起了轰动。继发性癌症是许多抗癌治疗中已知但...
|
|
FDA 生物制品负责人:CAR-T治疗后继发性癌症可能存...
2024.01.11
美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 于 1 月 8 日在再生医学联盟举行的一次活动上表示,尽管 FDA 仍在对接受 CAR-T 细胞疗法的患者后续发生淋巴瘤的病例进行调查,但 CAR-T 疗法已用于治疗 27000 名患者,其获益仍大于风险。
FDA 正在调查 22 ...
|
|
继对 CAR-T 疗法发起调查后,FDA 对 Carvykti ...
2023.12.27
美国 FDA 近日对强生和传奇生物的 CAR-T 治疗药 Carvykti 添加了黑框警告。传奇生物在 12 月 21 日提交的一份证券文件中表示,Carvykti 的黑框警告包括针对“继发性血液恶性肿瘤,包括骨髓增生异常综合症(MDS)和急性髓系白血病(AML)”的警告。
根据传奇生物称,此次更新是由 I...
|

|
FDA就CAR-T Kymriah生产CGMP问题向诺华发布无标题信
2023.12.07
美国 FDA 于 12 月 5 日公布了一封 8 月份发给诺华的无标题信,信中概述了 FDA 检查人员在诺华新泽西 Morris Plains 工厂发现的 Kymriah(tisagenlecleucel)生产过程中与 CGMP 要求的重大偏离。
无标题信(Untitled Letter)可认为是 483 以上而警告信未满的情况下发...
|
|
FDA正在调查CAR-T治疗后发生T细胞恶性肿瘤的严重风险
2023.11.29
美国 FDA 于 11 月 28 日发布公告表示,正在调查 CAR-T 疗法是否会在极少数情况下导致淋巴瘤(一种血癌)。
FDA 表示,“虽然这些产品获批用途的整体获益继续超出其潜在风险,但 FDA 正在调查已确定的 T 细胞恶性肿瘤风险及所导致的严重后果,包括住院和死亡,并正在评估...
|
|
FDA因死亡病例暂停2seventy公司的药物调控CAR-T试验
2023.08.16
美国 FDA 因一名接受治疗的急性髓系白血病(AML)患者死亡,暂停了 2seventy 生物公司一项 CAR-T 细胞免疫疗法的 I 期临床试验。这意味着该公司首个进入人体试验的药物调控 CAR-T 平台受阻。
今年6月,西雅图儿童医院一名参与 I 期试验第二剂量梯队的 AML 患者死亡。之后,2s...
|
|
诺华开发 CAR-T 疗法快速制造平台,可将生产时间缩...
2022.12.13
嵌合抗原受体(CAR)T 细胞免疫治疗产品是人类基因治疗产品,其中 T 细胞特异性经过基因改造,能够识别用于治疗目的所需的靶抗原。但是 CAR-T 的制造耗时较长,患者在符合条件后通常需要等待数周才能接受治疗药的输注。对于一些患有侵袭性癌症的患者,他们可能会在等待治疗到来时死...
|

|
最高法院拒绝受理 BMS 诉吉利徳的 CAR-T 专利侵...
2022.11.09
昨日我们报道了美国最高法院同意受理安进诉赛诺菲关于高胆固醇治疗药 PCSK9 单抗的专利侵权案,而紧接着最高法院驳回了百时美施贵宝(BMS)子公司 Juno 诉吉利徳的 CAR-T 专利侵权案的审理请求。
先简单说一下这个案子的情况:2017年,Juno(BMS 旗下)对Kite pharma(吉利德...
|

|
多家药企敦促美最高法重审CAR-T专利侵权案,吉利德表...
2022.09.01
7月18日,Amgen、GSK和Regenxbio等多家制药公司和研究机构向美国最高法院(SCOTUS)提交了“法庭之友”意见书(amici briefs),称联邦巡回法院最近的一项关于CAR-T专利侵权诉讼的裁决违背了先例,可能会颠覆整个生物制药创新的生态系统,并表示支持百时美施贵宝公司(BMS)对吉利德“19...
|
|
合成细胞疗法已在路上,FDA需做好监管准备
2022.08.03
发展新的医疗手段需要推动或者打破目前的治疗定义边界,其中一个边界就是对细胞的定义。目前为止,细胞都是一种纯天然的存在(beings),我们用活细胞来繁殖活细胞。但随着合成生物学家及工程师正在不断学习和创造合成细胞(非活细胞),有朝一日合成细胞可能会改变一系列疾病的治疗方式。...
|

|
业界对FDA的CAR-T研发指南草案的代表性反馈
2022.07.27
3月初,FDA发布“嵌合抗原受体(CAR)T细胞治疗的研发考量”的行业指南草案,旨在帮助申请人开发CAR-T细胞产品,涵盖了关于CMC、药理学和毒理学以及临床研究设计方面的建议。虽然该指南是针对CAR-T细胞产品开发提出的,但提供的大部分信息和建议也将适用于其他转基因淋巴细胞产品,例如CA...
|

|
专利范围过广?药企等待美国高院裁决热点单抗和CAR-T...
2022.07.27
制药公司的目的是获利,往往不想把时间和金钱投入到因竞争而无法从中获利的事情上,因此市场上药物创新数量往往较少。为了防止这种市场失灵,专利保护机制应运而生。然而过去的十年,美国联邦上诉法院屡次裁定单克隆抗体药物以及CAR-T疗法的专利应遵循更严格的申请标准,激起原研公司不...
|
|
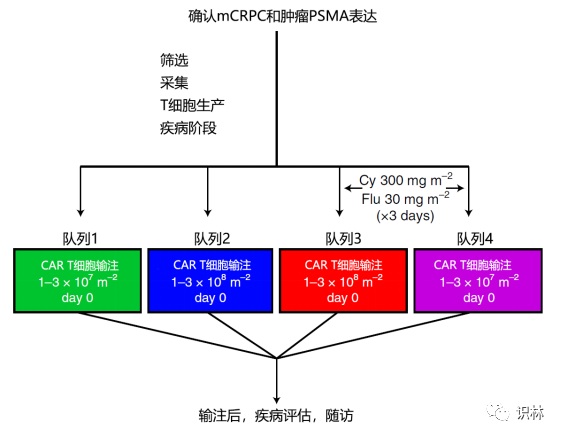
Nature 子刊论文:实体瘤 CAR-T 的关键挑战,以及...
2022.05.13
CAR-T 细胞治疗从根本上改变了血液系统恶性肿瘤的治疗格局。FDA 也在前不久发布了专门指南,见相关资讯:【FDA 发布 CAR-T 细胞治疗的研发考量指南草案】
CAR-T 治疗在血液肿瘤中的成功激发了人们对该技术在实体瘤中应用的热情。然而,实体瘤的生物学比血液系统恶性肿瘤更复杂。去年...
|