
|
欧美监管机构发布突破性治疗申请的 CMC 和 GMP 联...
2023.12.22
欧洲药品管理局(EMA)和美国 FDA 于 12 月 19 日发布了“EMA-FDA 关于 PRIME/突破性疗法应用的质量和 GMP 方面的联合问答”文件,以支持 EMA 优先药物(PRIME)计划和 FDA 的突破性治疗(BT)认定计划中产品的质量开发。
PRIME/BT 两个计划旨在帮助加快创新产品的开...
|

|
细胞治疗产品常见的 CMC 和 GMP 检查缺陷分析
2023.12.13
最近细胞治疗产品企业的 CMC 和 GMP 问题可能给药企带来了深刻的教训。识林分享一篇今年 9 月份给企业会员发送的分析文章,希望大家能够吸取经验教训,早做准备。
另外,还可参考识林去年发布的 FDA 对细胞和基因治疗产品的检查和常见缺陷统计以及最近 FDA 因 CGMP 问题向诺华 C...
|

|
FDA 招募IND申办人参与 CMC 开发和准备试点计划
2023.09.14
美国 FDA 于 9 月 11 日公布了有关其新的化学、制造和控制(CMC)开发和准备试点(CDRP)计划的更多细节,旨在通过与 FDA 的更多互动来帮助企业改善 CMC 准备情况,促进突破性或加速审批产品的开发。
该试点项目将于 10 月 3 日开始接受申请,有兴趣的申办人能够以对活跃...
|
|
FDA 基因治疗产品审评团队负责人谈生产变更等 CMC ...
2023.05.01
美国 FDA 生物制品审评与研究中心(CBER)治疗产品办公室(OTP)官员敦促基因治疗产品的开发者避免在后期关键性研究期间实施生产工艺变更,以免以后出现问题,例如产品超标(OOS)。
在 4 月 25 日的网络研讨会上,OTP 基因治疗 1 处的团队负责人 Graeme Price 回答了利益...
|

|
【问答整理】细胞和基因治疗的CMC和GMP监管和产业研讨...
2023.04.11
2023年3月30-31日,IPEM教学项目和识林知识平台,联合中国药品监督管理研究会细胞与基因治疗产品监管研究专委会,邀请GMP指南再版修订撰写专家,及中美药监和产业专家,在北京大学举办“细胞和基因治疗产品的CMC和GMP监管和产业研讨会”。会议由中国药品GMP(2010年修订)起草小组主要执...
|

|
细胞基因治疗产品CMC和GMP监管产业研讨会简报
2023.04.04
2023年3月30-31日,IPEM教学项目和识林知识平台,联合中国药品监督管理研究会细胞与基因治疗产品监管研究专委会,邀请药品GMP指南再版修订专家,及中美药监和产业专家,在北京大学举办“细胞基因治疗产品CMC和GMP监管产业研讨会”。
会议由我国药品GMP(2010年修订)起草小组主要执笔...
|

|
FDA 启动 CMC 开发和准备试点计划,促进研究性新药...
2022.10.31
美国 FDA 于 10 月 31 日在联邦公告上发布通告,宣布启动化学、制造和控制(CMC)开发和准备试点(CDRP)计划,以基于患者更早获得产品的预期临床获益,在必要情况下促进在研究性新药(IND)申请下产品的加速 CMC 开发。
FDA 表示实施这一试点计划是为了帮助一些被监管产品做好...
|
|
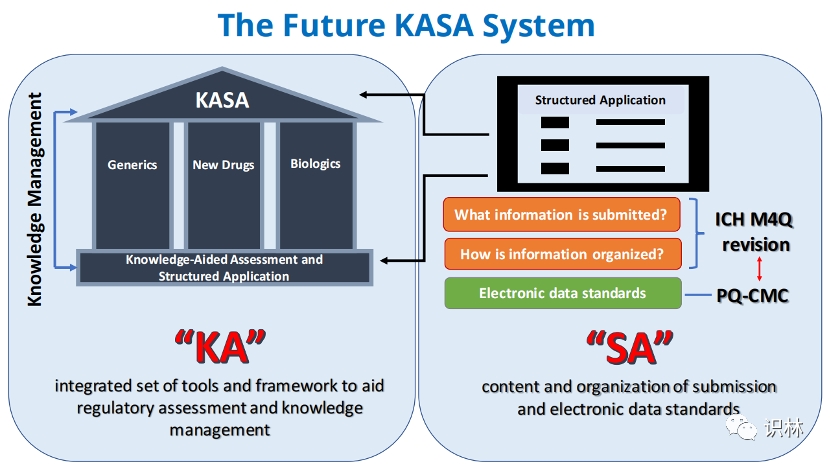
申报和审评数字化变革的回顾与展望:KASA,PQ CMC,Ac...
2022.10.26
美国FDA将在11月2-3日举行一场特殊的专家会,讨论质量成熟度和KASA。FDA 将在这场会上寻求业界和公众对KASA愿景的意见,并计划在未来5年内扩大KASA。另外,第6次2022年FDA/PQRI(Product Quality Research Institute,药品质量研究协会)联合会议预期将在年底举办。
在这两次重...
|
|
FDA 神经退行性疾病的人类基因治疗定稿指南
2022.10.25
美国 FDA 于 10 月 21 日发布了“神经退行性疾病的人类基因治疗”定稿指南,为开发相关产品的生物制药公司提供化学、生产和控制(CMC)、临床前研究以及临床试验设计等方面的指导。
该定稿指南以 2021 年 1 月的指南草案为基础,同意了行业反馈的一些要求,包括修改指南中关...
|

|
FDA 发布 CMC 批准后变更可比性方案定稿指南
2022.10.19
美国 FDA 于 10 月 13 日发布了“NDA、ANDA 或 BLA 中化学、生产与控制信息批准后变更的可比性方案”定稿指南,以帮助企业通过使用可比性方案(CP)实施化学、生产和控制(CMC)批准后变更。
定稿指南与 2016 年 4 月发布的草案版本相比有一些变化,主要包括将 ICH Q...
|

|
IPEM 课程 生物产品CMC的生命周期策略:分析方法、...
2022.09.05
分析方法在生物制药和质量控制上的应用
讲师:郭允籣
时间:9月17-18日上午
地点:苏州
老师简介
郭允籣女士,现任信达生物制药集团全球R&D运营负责人。曾先后在美国Amgen、Abbott和Genzyme等生物制药公司从事产品开发并担任产品负责人及CMC负责人,有25年以上从事蛋白...
|

|
IPEM 课程 欧美GMP迎检,无菌保证,大分子CMC
2022.07.18
老师简介
李晓明博士,PSQ+公司创始人,曾就职于美国默克制药、美国礼来制药和浙江海正药业。在近30年制药生涯中,创立了一套完整的固体口服制剂理论和制剂药物研发、生产、工艺优化的技术和方法,在领导力培养、质量组织框架搭建、质量管理体系高效率系统化设计、跨北美、欧洲...
|

|
CTD和eCTD仍然不够,Accumulus计划推动云端CMC标准化...
2022.07.07
在过去三十年里,从娱乐到商业到艺术,多个行业通过互联网发展得如火如荼,生物制药和监管机构之间的信息和数据交换在某些方面落后。提交新药申请可能已经从送一卡车纸张到相关监管机构,到联邦快递(FedEx)的CD-ROM,再到通过电子提交网关上传一套PDF,但文件本身和基本流程几乎没有改...
|

|
【问答回顾】疫苗CMC和GMP专题课精彩问答摘录
2022.05.26
5月21-22日,IPEM 邀请WHO的Ian Thrussell 先生和 Wacharotayankun 博士远程讲授疫苗专题的系列课程,并和来自PATH的高光博士一起在线答疑。
Wacharotayankun博士是疫苗CMC审评专家,参与了多项国外和国内疫苗产品的CMC审评,Ian Thrussell和高光博士最近两年在多家中国疫苗...
|

|
IPEM 课程 疫苗CMC和GMP:WHO专家讲解及在中国企业...
2022.05.16
以下文章来源于IPEM ,作者IPEM
新冠大流行带来了疫苗产业的热潮。4月初,WHO因GMP检查中发现缺陷,暂停采购印度Bharat Biotech生产的新冠疫苗Covaxin。Bharat Biotech也主动提出,因预期疫苗的需求减少,将减少Covaxin的生产。现在WHO已授权了超过10种新冠疫苗的紧急使用,接种率在...
|

|
FDA 定稿可通过年报记录的指定生物制品的 CMC 批准...
2021.12.10
美国 FDA 于 12 月 9 日发布题为《年报记录指定生物制品的 CMC 批准后生产变更》定稿指南。可在年报中提交的 CMC 变更被视为次要变更。
FDA 表示,定稿指南更新了 2017 年 8 月发布的同名指南草案。在指南定稿时,FDA 考虑了收到的对指南草案的意见,根据收到的意见,FD...
|

|
FDA 发布质量相关受控函的问答,涵盖仿制药常见 CMC...
2021.09.23
美国 FDA 药品审评与研究中心(CDER)于 9 月 20 日发布了一份题为《质量相关受控函问答》的指南草案为仿制药申请人提供药品质量领域常见问题的解答。新指南旨在对此类问题提供直接答案,以减少有关相同主题的受控函数量。
指南采用问答形式,涵盖了 FDA 关于质量相关科学和监...
|

|
FDA 发布生物制品 CMC 批准后变更定稿指南
2021.06.23
美国 FDA 于 6 月 21 日发布了《已获批生物制品申请的 CMC 变更》定稿指南,帮助生物制品制造商确定其产品哪些类型的变更应在年报中提交,哪些需要提交需事先批准的补充申请(PAS)。
该指南的草案版本于 2017 年 12 月发布,定稿指南对草案做了一些细微的更改。指南涵盖的...
|

|
【周末杂谈】ICH M9,创新与监管科学
2021.05.23
从CMC的角度看,创新药与仿制药的研制有那么不同吗?
5月11日,美国FDA发布了题为“M9 基于BCS分类的生物等效豁免(M9 Biopharmaceutics Classification System-Based Biowaivers)”。其实这就是ICH指导原则 M9。三年前,FDA就发布这个指南征求意见稿了。这次,几乎未作任何修...
|

|
CMC 项目带头人的作用有哪些?
2021.01.15
转载自 IPEM,原文标题“生物药CMC与项目带头人”
“CMC项目带头人”(CMC Lead或CMC Leader)不同于“项目经理”,工作重点不是项目内容、进度和预算的行政管理,而是带领团队取得项目的成功。生物药CMC(Chemistry, Manufacturing和Control)是技术活,其成功离不开专业知识和实...
|