
|
欧盟药品短缺网络试点进入第二阶段
2020.01.17
欧洲药品管理局(EMA)和药品机构(HMA)于2016年12月成立了HMA/EMA人用和兽用授权药品供应https//www.hma.eu/522.html 特别工作组,以提供战略支持和建议,来解决人用药和兽药供应中断的问题,并确保其持续供应。其主要优先事项包括
研究如何利用现有的监管框架(例如,通过工...
|
|
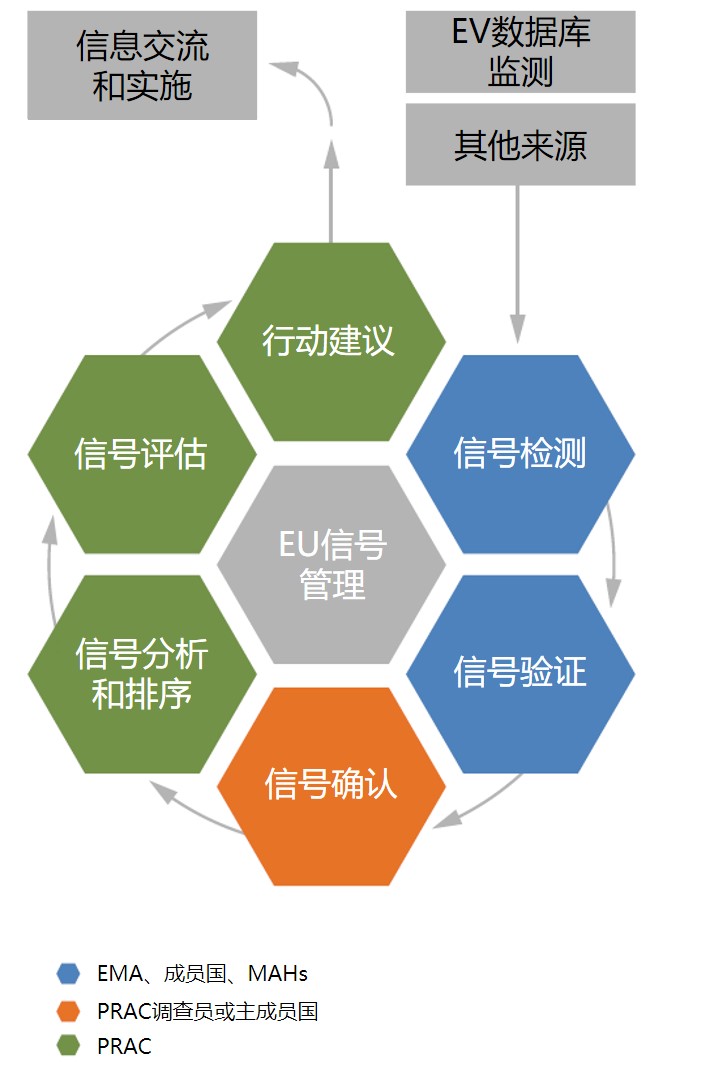
欧盟延长安全信号检测试点至 2021 年底
2020.01.08
安全信号是指新的或已知的可能由药物造成,并需进一步研究的不良事件的信息,它的来源包括:自发报告、临床研究、科学文献等。欧盟法规要求上市许可持有人(MAH)持续监测药物警戒系统数据,并向欧洲药品管理局(EMA)和成员国药监局报告检测到的经验证的安全信号。
欧盟的安全信号检测...
|

|
欧洲药品管理局着手机构改革,应对新挑战
2019.12.24
欧洲药品管理局(EMA)将着手开展涉及机构改革的“面向未来”的行动,以使其能够更有效地应对“人员的永久减少”以及在科学、技术和立法方面的新挑战。
EMA 管理委员会 12 月会议上提出的新架构包括成立四个新的工作组,以聚集在“高影响力领域”的专家,例如数字化转型、监管科学与...
|

|
无菌药品检查国际合作试点启动,中国和印度或将面临更...
2019.12.19
欧洲药品管理局(EMA)于 12 月 17 日宣布启动一项为期两年的无菌药品 GMP 检查国际合作试点计划,该计划可以使包括欧盟、美国、英国、澳大利亚、加拿大、日本等国在内的监管机构共享无菌药品生产场地的 GMP 检查信息。参与机构由此而节约的检查资源或将更多的集中在高风险场地和...
|

|
EMA 领导人对 2030 年药物警戒的三大趋势预测
2019.12.17
到 2030 年,药物警戒的关键因素将包括更智能地收集和报告可疑不良反应的安全报告,衡量在市场上的药品表现以及改善监管机构、患者和医疗保健专业人员之间的互动。以上这些预测来自欧洲药品管理局(EMA)执行主席 Guido Rasi、EMA 安全委员会(PRAC)主席 Sabine Straus 以及 EMA...
|

|
EMA 将采取措施避免药品审评过程中的偏见
2019.11.28
几个月前我们曾报道过欧洲监察使建议欧洲药品管理局(EMA)采取几项措施,以确保与制药商就上市申请进行的申报前会谈不会影响审批决定。【申报前会议可能给 EMA 审批过程带来偏见? 2019/08/16】现在故事有了新进展,EMA 宣布同意采纳欧洲监察使的建议。
EMA 在 11 月 21 日回应...
|
|
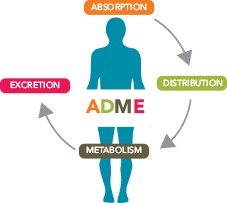
药物吸收代谢研究问题仍是欧洲申报普遍缺陷
2019.11.12
人体内质量平衡研究(human mass balance study)也被称为吸收、分布、代谢和排泄(ADME)研究,是了解新化学实体的药代动力学(PK)特性所需的临床药理学资料包中提供最多信息的研究之一。人体内质量平衡研究中通常包括单剂量和多剂量 PK 研究、相互作用研究(包括食物相互作用)、...
|

|
欧盟关于发现、管理和沟通药品短缺问题的指南
2019.10.28
上周我们介绍了美国 FDA 提议通过评级体系,让采购方可以了解有关药品生产设施生产质量方面的更多信息,从而可以选择向具有成熟质量管理体系的生产商支付更多费用,来奖励生产商在质量方面的投资,更可靠的供应药品,以预防药品短缺。【FDA 提出应奖励具有成熟质量体系的制药商以预防药...
|

|
EMA 指明亚硝胺污染的潜在来源
2019.10.23
欧洲药品管理局(EMA)于 10 月 18 日更新“对上市许可持有人(MAH)关于亚硝胺信息”的问答指南,增加第 12 个问题,列出了药品中亚硝胺污染的潜在来源,以帮助企业遵守 EMA 最近对于企业在亚硝胺污染方面的审查和评估要求。
在上月初美国一家在线药房发现赛诺菲的抗酸药 Zant...
|

|
研究显示 EMA 和 FDA 在批准决策方面高度一致
2019.08.26
根据一项最新研究对欧洲药品管理局(EMA)和美国 FDA 在 2014 年至 2016 年间 107 件申请的分析显示,两家机构对超过 90% 的申请做出了同样的决策。这项 7 月份发表在《临床药理学与治疗学》杂志上的研究是两家机构间开展的首项此类研究。
研究者表示,EMA 与 FDA 之间...
|

|
申报前会议可能给 EMA 审批过程带来偏见?
2019.08.16
经过两年的调查,欧洲监察使建议欧洲药品管理局(EMA)采取几项措施,以确保与制药商就上市申请进行的申报前会谈不会影响审批决定。
欧洲监察使 Emily O'Reilly 对于企业与监管机构之间申报前的会谈表示担忧并展开调查,她指出,这些会谈可能会产生偏见,或者企业可能会以某种方式...
|

|
EMA发布集中程序获批药品抽样与检验20年报告
2019.04.05
3月28号,欧洲药品管理局(EMA)发布了集中审评程序获批药品抽样与检验20年报告pdf,总结了1998年至2017年的工作内容。
抽样与检验项目旨在监督欧洲市场上的集中审评药品质量,由欧盟委员会(European Commission)、欧洲药品管理局(European Medicines Agency)、欧洲药品质量管理局(...
|

|
欧洲药品管理局总部将于 3 月初搬迁至荷兰阿姆斯特...
2019.01.26
欧洲药品管理局(EMA)将在2019年3月初搬迁至荷兰。荷兰当局已经在2019年1月9日将位于阿姆斯特丹Sloterdijk镇的临时性建筑“Spark”大厦正式移交给EMA的执行董事Guido Rasi。EMA现在正在准备正式搬迁。搬迁期间,EMA必须同时确保其主要监管活动的继续进行,并相应的启动其“业务连续性...
|

|
EMA 和 FDA 将联手解决加快审批产品的质量问题
2018.08.05
欧洲药品管理局(EMA)和美国 FDA 计划于今年 11 月份召开研讨会,讨论监管机构的早期评估项目 — EMA 的 PRIME(优先药品)计划和 FDA 的突破性治疗认定(BTD)计划下药品研发所面临的质量和生产相关问题。
研讨会将于 11 月 26 日在 EMA 伦敦总部召开,届时欧盟监管机构...
|

|
欧洲药品管理局(EMA)采取措施缓和GMP问题导致的关键...
2018.04.12
作为修订应对GMP相关的“关键”药品短缺程序的第一步,EMA正在对用于宣布GMP违规的模板进行公开磋商。
欧洲药品管理局(EMA)正计划采取进一步措施,改进和协调应对可导致的“关键”药物短缺的严重的GMP违规情况的程序。这些措施中,包括明确规定在哪些情况下可放行受影响的多...
|

|
2017 欧盟药品监管大事速览
2017.12.31
过去的一年对于欧盟监管机构来说是忙碌的。这篇资讯我们从欧盟监管角度来看看 2017 年的一些关键事件。
或许一些读者可能会认为英国退欧是欧洲监管方面在 2017 年的唯一一个重大事件,但在试图为英国预期于 2019 年 3 月底从欧盟离开做好准备之外,还有很多事情需要监管者和企...
|

|
欧洲药品管理局总部将迁至荷兰阿姆斯特丹
2017.11.21
经过数月激烈的政治争斗,欧洲委员会于 11 月 20 日投票决定将欧洲药品管理局(EMA)总部从英国伦敦迁至荷兰阿姆斯特丹。
旗鼓相当的投票结果意味着 EMA 选择阿姆斯特丹可能会比选择亚军米兰遇到稍少的干扰。最近一项对 EMA 工作人员的问卷调查青睐于阿姆斯特丹优秀的国际航班...
|

|
欧盟检查员 2016 年发现的临床试验缺陷过千
2017.08.22
欧盟药品临床质量管理规范(GCP)检查员在 2016 年全球试验场地总共发现 1033 个缺陷,其中 9% 被认为是“关键缺陷”,略超过一半是“重大缺陷”,约三分之一是“微小缺陷”。问题包括不完整的文件、源数据和临床研究报告中的信息之间的不一致,以及试验监测方面的缺陷。缺陷总数相比 ...
|

|
EMA 2016年报:科学、医学和卫生方面的进展
2017.05.15
在欧洲药品管理局(EMA)离开伦敦并失去英国专家(897 名 EMA 员工中有 60 名来自英国)的可能性越来越高的时候,EMA 于 5 月 10 日公布了 2016 年年度报告,概述了其 2016 年的成功 — 27 个新药获得许可并启动了几项新计划。
同美国 FDA 一样,EMA 正在越来越快...
|

|
EMA-FDA QbD 联合试点项目发布最终报告
2017.04.21
欧洲药品管理局(EMA)和美国食品药品管理局(FDA)完成了评估包含质量源于设计(QbD)元素的药品申请的联合试点项目,并于 4 月 19 日发布最终报告。
背景
联合试点项目最初于 2011 年 3 月根据美国-欧盟保密协定启动,初始定为三年,在 2014 年第一阶段完成后,双方同意...
|