
|
欧盟药物短缺新战略:建自愿团结机制,改革最低价竞标
2023.10.31
欧盟委员会(EC)于 10 月 24 日宣布采取新战略,包括通过允许各国共享药品、提高监管灵活性、提高生产能力以及指导招标采购标准来解决药品短缺问题。
EC 将启动“欧洲自愿团结机制”,允许面临短缺的国家向其他供应更充足的国家请求药品。自愿团结机制由欧洲药品管理局(EMA)药...
|

|
欧盟CMDh更新市场保护或数据专营延长的决策SOP
2023.07.07
2023年6月,CMDh更新了题为“CMDh 关于新活性物质状态或市场保护或数据专营延长决策过程的 SOP”的文件,对CMDh做出市场专营期或数据专营期延长决策的流程进行了说明。
欧盟关于数据专营期或市场专营期延长的策略
在欧盟的集权程序(Centralized Procedure,CP)下,新药申请上市...
|
|
欧盟发布指南提出 10 点建议解决药物短缺问题
2023.05.24
欧洲药品管理局(EMA)于 5 月 17 日发布《预防人用药短缺的行业良好实践》指南,列出了利益有关者可以采取的 10 项措施来解决潜在的药品短缺问题。提供了关于上市许可持有人(MAH)、批发商、分销商和生产商可考虑采用的最佳做法的建议,以确保药品供应的连续性并减少短缺的影响。...
|

|
欧洲发布立场文件,希望在短缺情况下增加药品供应
2023.05.10
近年来,药品短缺对美国和欧洲都产生了影响,随着欧洲出现抗生素和胰岛素短缺,各成员国正在寻找改善药品供应的解决方案。
5 月 2 日由比利时政府起草发布的一份立场文件中,包括德国和法国在内的 19 个欧盟成员国表示,药品短缺一直在持续增加,75% 的受访国家去年报告显示药品...
|

|
欧盟公布专利改革提案,关注强制许可和补充保护证书
2023.05.03
欧盟委员会于 4 月 27 日发布了一揽子法规,建立欧盟范围内的强制许可计划,允许其它公司在紧急情况下不经专利持有人同意即可生产药品。法规还将建立欧盟区域范围的补充保护证书(SPC),对专利药品的期限最多可再延长五年。目前,SPC 仅在国家层面授权。
委员会表示,这些提案“...
|

|
欧盟发布报告分析原料药生产回归本土的利弊和促进措施
2023.03.16
欧盟于本月初发布了一份题为“促进原料药(API)生产的潜在措施”的报告,分析了欧盟 API 生产的现状,回归本土过程中潜在的获益和挑战,探讨了促进欧盟 API 生产的措施。
这份长达 58 页的报告指出,在过去十年中,欧洲国家的药品短缺一直在增加,而且随着新冠大流行而加剧...
|

|
欧盟监管机构 2025 工作计划重点:提高药品供应
2022.02.23
欧盟成员国人用药互认和分散程序协调小组(CMDh)最新发布的到 2025 年的多年度工作计划中的关键优先事项之一是改善欧盟基本药物的供应。
工作计划概述了 CMDh 为解决优先领域而打算采取的几项短期和长期行动。提高药品供应,尤其是基本药品的供应是首要任务。CMDh 在工作计划中指...
|

|
欧盟因新冠疫情继续延长 GMP 和 GDP 证书有效期
2021.10.04
由于新冠疫情继续给 GMP 和 GDP 现场检查带来困难并且为了最大程度减少因新冠疫情对药品生产和供应造成的干扰,欧盟监管机构已将现有证书和限时许可的有效期延长至 2022 年底。这是欧盟自疫情以来第二次延长 GMP/GDP 证书有效期。【欧盟和英国在疫情期间放宽部分 GMP 要求 2020/04...
|

|
欧盟计划收紧部分药物警戒要求,加强对第三方的合规监...
2021.09.07
根据欧盟委员会(EC)的新提案,欧盟上市许可持有人将被要求加强对转包给第三方的药物警戒服务的监督,并更多地利用 EudraVigilance 药物安全数据库来帮助改进对安全信号的评估。
这些提议是在 9 月 1 日发布的征求意见文件中提出的,旨在更新 2012 年的实施条例(IR),该条例...
|
|
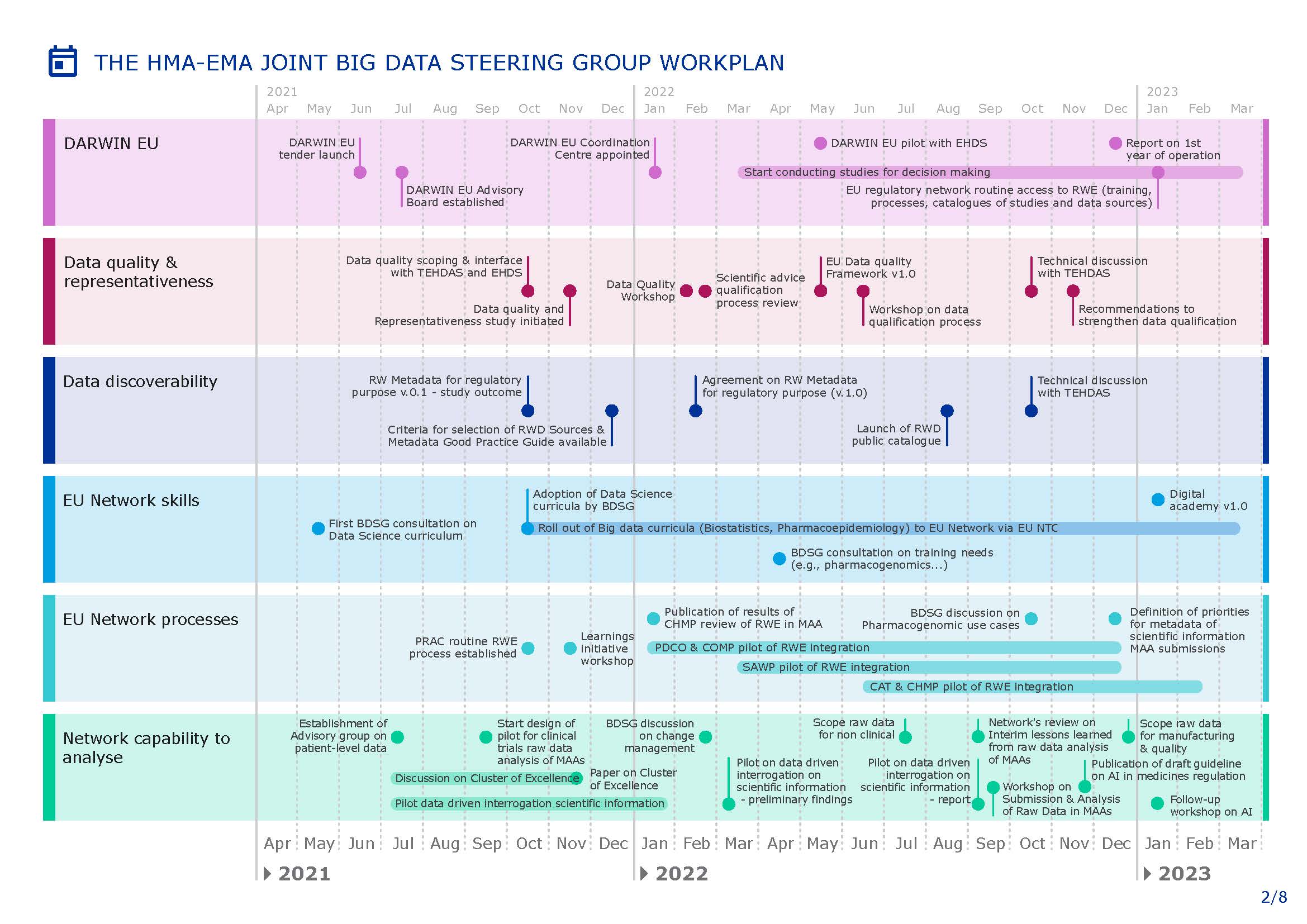
欧盟发布 2021-2023 年大数据工作计划
2021.08.30
欧洲药品管理局(EMA)和欧盟药品机构(HMA)的联合指导小组最近发布了其旷日持久的大数据工作计划的更新,以解决与医疗卫生和药品开发中的大数据相关的问题。
根据 EMA 的大数据网页,指导小组于 6 月通过并于 8 月 27 日发布了 2021-2023 年工作计划,“旨在从数据质量到...
|

|
欧盟孤儿药和儿科用药法规修订拟议遭业界反对
2021.08.07
欧盟委员会关于改革欧盟儿童和罕见病药物立法的最新磋商引发了利益相关者的一些尖锐回应。以研发为基础的欧洲制药业再次 拒绝了减少孤儿药和儿科药物开发激励、促进更快的仿制药和生物类似药竞争以及引入“未竟需求(unmet needs)”的法律定义的提议。
根据欧盟委员会的说法,虽然欧...
|
|
欧盟无菌 GMP 附录修订进展与业界疑虑
2021.03.24
制药行业目前仍对欧盟委员会关于无菌 GMP 附录(Annex 1)的修订有所担忧。行业和监管人员在 3 月 16 日召开的 ISPE 年度无菌会议上介绍了欧盟无菌附录的最新进展,谈到了仍然产生混乱的一些方面并讨论了将受到无菌附录影响的一些领域。
目前讨论的附录修订版于 2020 年 2 月...
|

|
欧盟推出试点项目了解制药企业的新产品上市计划
2021.03.10
欧洲药品管理局(EMA)和欧盟委员会(EC)宣布将于 3 月 25 日启动一项试点项目,旨在通过为监管机构提供针对申办人上市计划的“预警系统”,缩短某些肿瘤产品的上市时间。该试点项目还计划寻求理解欧盟国家中某些产品投放不平衡的背后原因。
试点项目计划持续到 2022 年 8 月...
|

|
欧盟宣布应对新冠病毒变体的新计划
2021.02.19
欧盟于 2 月 17 日宣布了一项应对新冠(COVID-19)病毒变体的计划:将建立一个新的称为“HERA 孵化器“的生物防御准备计划,与欧盟和全球研究者、生物技术公司、制药商和公共机构合作,检测和评估新变体,为开发新型和调整疫苗提供激励措施,加快这些疫苗的批准程序,并确保扩大生产能...
|
|
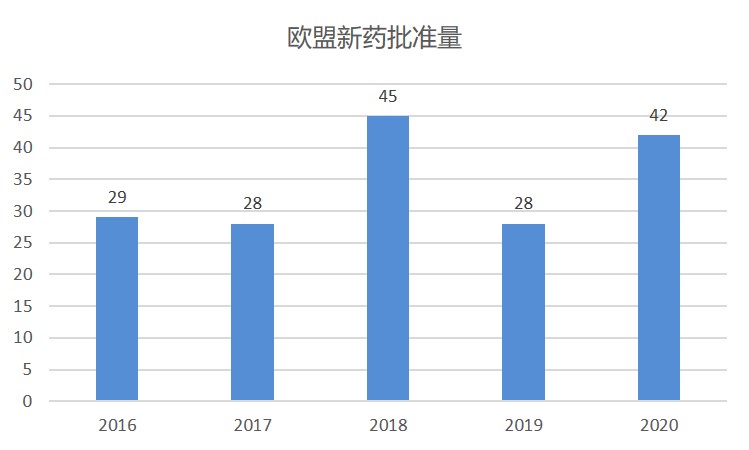
2020 年欧盟新药批准情况一览
2021.01.20
2020 年,欧洲药品管理局(EMA)总共有包含 41 个新活性成分的 42 个新药产品,与 2019 年许可的 28 个含新活性成分的产品相比有大幅增加,略低于 2018 年的 45 个。
去年值得注意的获批产品包括首款用于 COVID-19 的疫苗 — 辉瑞/BioNTech 公司的 Comirnaty,以及吉利德(...
|

|
欧盟附条件批准辉瑞-BioNTech 新冠疫苗
2020.12.22
欧洲药品管理局(EMA)于 12 月 21 日周一建议欧盟委员会对辉瑞/BioNTech 的新冠(COVID-19)疫苗授予附条件上市许可,几个小时后欧盟委员会对疫苗签发了正式附条件上市许可(CMA)。欧盟范围内的首次疫苗接种预计将在本周末(12 月 27 日)开始。
EMA 对 COVID-19 疫苗...
|

|
欧盟基因和细胞治疗药物开发指南,含 CAR-T 细胞的...
2020.12.21
欧洲药品管理局(EMA)更新了其针对具有转基因细胞的新药开发的行业指南,其中包括有关嵌合抗原受体 T(CAR-T)细胞治疗药物的特殊临床考虑的附录。新指南指出,“EMA 已经认识到,这是一个不断发展的领域,指南应可以在合适的情况下应用于任何新产品。”
这份 36 页的指南提供了...
|
|
欧盟新冠疫苗专家投票日期提前,使用附条件批准路径
2020.12.17
欧洲药品管理局(EMA)迫于政治压力预期将在下周就首个新冠(COVID-19)疫苗给出附条件上市批准建议。
EMA 之前计划“最迟”在 12 月 29 日之前就辉瑞/BioNTech 的 COVID-19 疫苗 BNT162b2 做出决定,但现在将这一决定提前至 12 月 21 日。EMA 专家的预期投票结果将...
|

|
欧洲药品监管 2025 战略关注药品可及性和供应链挑战
2020.12.15
欧洲药品管理局(EMA)和欧盟药品机构(HMA)于 12 月 8 日发布了《2025 药品监管网络战略》,对于未来五年的欧盟药品监管网络,药物可及性和可获得性被列为首要议题,其次是创新、供应链挑战、抗菌素耐药性等问题。
与战略同时发布的还有对战略草案征求意见结果的分析和总结,战...
|

|
欧盟发布药物战略强调仿制药竞争和强制许可等问题
2020.11.27
欧盟委员会于 11 月 25 日最新发布了《欧洲药物战略》,提出了一系列与仿制药和生物类似药相关的建议,其中包括旨在改善竞争、消除障碍、增加卫生系统利用和患者利用率的针对性政策。
欧洲药品战略旨在通过建立一个具有前瞻性的监管框架,支持行业促进可以真正到达患者并满足他们的...
|