
|
FDA 发布2024财年仿制药科学和研究工作重点
2024.01.18
美国 FDA 于 1 月 8 日发布了其计划在 2024 财年根据仿制药使用者付费计划再授权(GDUFA III)下开展的科学和研究项目。FDA 根据公众反馈意见、公开研讨会的讨论确定了将在 2024 财年支持的八个优先研究领域。
这八个领域涵盖了仿制药行业和 FDA 仿制药计划认为在未来几...
|

|
合规专家点评FDA警告信后会议指南草案
2023.09.21
美国 FDA 于 9 月 5 日发布了题为“GDUFA 下的警告信后会议”的指南草案,概述了某些仿制药生产场地可以要求与 FDA 召开警告信后会议(Post-Warning Letter Meeting)的程序,在会议上药企可以与 FDA 讨论正在进行的补救和纠正措施,以解决警告信中提到的 CGMP 缺陷。
...
|
|
FDA 2023 仿制药论坛上报告的 GDUFA III 相关要...
2023.04.26
美国 FDA 于 4 月 12 日 - 13 日举办了年度仿制药论坛,今年的主题是庆祝仿制药论坛 10 周年。FDA 仿制药领域相关工作人员在会上从 FDA 仿制药审评计划的各个方面作了详细报告。论坛的目的是提供实用建议和说明简化新药申请(ANDA)审评过程,为仿制药申请人提供信息。完整...
|

|
FDA 开始恢复仿制药申报沟通面对面会议
2023.03.29
2023年3月27日起,FDA仿制药项目除了视频会议外,还将分阶段恢复与行业的面对面(face-to-face,FTF)会议。
初期,面对面会议仅适用于申请人请求以此方式进行的ANDA产品开发会议和提交前会议。考虑到FTF会议可能会受到设施能力和后勤考虑的限制,因此,对于无法以面对面形式进行的AND...
|

|
FDA 发布 2022 财年仿制药科学与研究报告,总结 1...
2023.02.02
美国 FDA 仿制药办公室于 1 月 31 日发布了“2022 财年 GDUFA 科学与研究报告”,总结了 2022 财年根据仿制药使用者付费修正案(GDUFA)在 13 个不同科学领域开展的研究活动。
GDUFA 科学研究计划对于复杂产品尤为重要,这些产品更难开发仿制药。计划支持开发创新方...
|

|
FDA 更新受控函指南草案,扩展可通过受控函索取信息...
2022.12.23
美国 FDA 于 12 月 21 日发布了“仿制药研发相关的受控函”更新指南草案,以协助仿制药商通过受控函流程向 FDA 索取信息。指南反映了作为仿制药使用者付费修正案(GDUFA III)重新授权的一部分的变化,并扩展了有资格通过受控函索取信息的主题。
该指南草案定稿后将取代 2020 ...
|

|
FDA 更新仿制药优先审评申报前设施通信指南草案
2022.12.06
美国 FDA 于 12 月 2 日发布了题为“ANDA:与优先仿制药申报相关申报前设施通信”指南草案,包含与简化新药申请(ANDA)审评项目中申报前设施通信(PFC)的内容、时间和评价相关的仿制药项目增强,这是仿制药使用者付费修正案重新授权(GDUFA III)的一部分。
最早在 GDUFA II...
|

|
FDA 2022 财年仿制药批准数据趋势与分析
2022.11.14
美国 FDA 仿制药办公室(OGD)最近更新了 2022 财年全部仿制药使用者付费(GDUFA)批准和接收数据。2022 财年 FDA 共完成 722 件简化新药申请(ANDA)完全批准,比去年多出 43 件,但也不及前几年,比 2019 财年创造了历史最高批准记录的 935 件更是少了 213 件。原始 ANDA...
|

|
FDA 发布多篇指南阐明 GDUFA III 中的新承诺
2022.10.07
美国 FDA 于 10 月 5 日更新了四篇指南,以阐明如何应对最新仿制药使用者付费修正案(GDUFA III)中做出的新承诺。FDA 修订了根据 GDUFA II 发布的指南,并阐明了计划如何推进 2023 财年至 2017 财年的新 GDUFA 计划。
竞争性仿制药
FDA 更新了 2020 年发布的关...
|

|
FDA公布2023财年仿制药收费费率,API和CMO场地费下调...
2022.10.06
美国 FDA 于 10 月 5 日在《联邦公报》上公布了各类使用者付费项目(UFA)2023 财年(2022年10月1日至2023年9月30日)的费率。
今年情况比较特殊,支持各项 UFA 重新授权的法案在最后关头 9 月 30 日才在国会通过并由总统最终签署成为法律。这直接导致的后果就是 2023 财年...
|

|
GDUFA III 新变化:厂房设施未准备好接受检查将推迟...
2022.10.06
美国 FDA 近日发布了“厂房设施准备:GDUFA 下的目标日期决定”指南草案,专门用来说明仿制药使用者付费重新授权法案(GDUFA III)下的厂房设施是否准备好接受检查对于 GDUFA 目标日期的影响。
这是 GDUFA III 中做出的一些改进措施之一,旨在提高审评过程的效率并提高首轮批准率...
|

|
FDA 使用者付费再授权谈判即将到达截止日期,各方正...
2022.09.12
距离目前美国 FDA 使用者法案的到期仅剩几周的时间,国会各方正在就这一为 FDA 提供大规模数十亿美元资金的立法加紧谈判议程。
上周民主党人向包括共和党参议员 Richard Burr 在内的共和党人提出了还价议案,Burr 之前曾在 7 月份提出一项不含任何改革措施的“简单重新授权法案”...
|

|
索性一切归零?使用者付费再授权迫在眉睫,美议员提出...
2022.07.28
8月起国会将开启“休假模式”,所以使用者付费法案重新授权的最后期限可谓迫在眉睫,但此时总体的进度却并不乐观,众议院与参议院的两个版本仍存在非常大的差异。如果没有在8月前敲定最终的法案版本,这就意味着使用者付费法案所涉及的数千名FDA员工将收到“解雇通知”。在此危急之时,美...
|

|
用户付费法案再授权喧嚣不止,国会施压 FDA 接下来...
2022.05.17
UFA,User Fee Act 或者 Amendment,即用户付费法案,或称申请人付费法案。其本质上是一份“收钱办事”的协议(deal),首先各路利益相关方游说国会立法者,之后国会授权 FDA 收取费用,同时 FDA 向国会和相关方承诺工作目标,由此形成一种审评审批制度的动态调整机制。
一系列 ...
|

|
FDA 用户付费法案再授权,国会想“顺便”立法,业界...
2022.03.21
UFA,User Fee Act或者Amendment,即用户付费法案,或称申请人付费法案。其本质上是一份“收钱办事”的协议(deal),首先各路利益相关方游说国会立法者,之后国会授权FDA收取费用,同时FDA向国会和相关方承诺工作目标,由此形成一种审评审批制度的动态调整机制。
目前的UFA有14种之多...
|
|
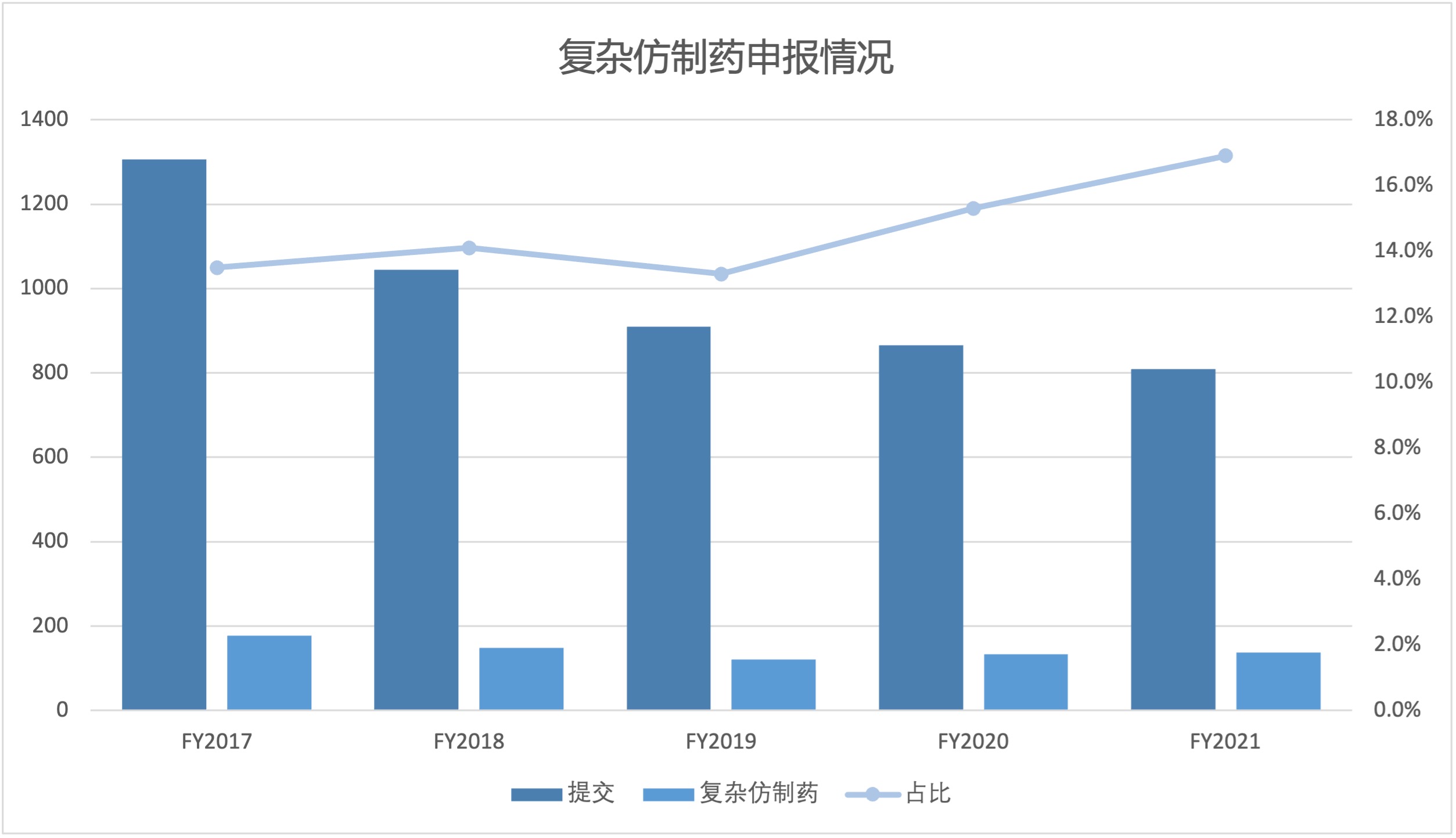
FDA 复杂仿制药申请日益增长,需分配更多审评资源
2021.11.24
2021 财年,美国 FDA 复杂仿制药批准占所有简化新药申请(ANDA)批准的 13% 以上,自 2017 财年以来,复杂仿制药批准呈稳步增长趋势。随着复杂产品申请份额逐渐增加,FDA 可能需要调整其内部人员配备和其它资源来适应变化。
美国 FDA 仿制药办公室(OGD)研究与标准办公室 Robert L...
|
|
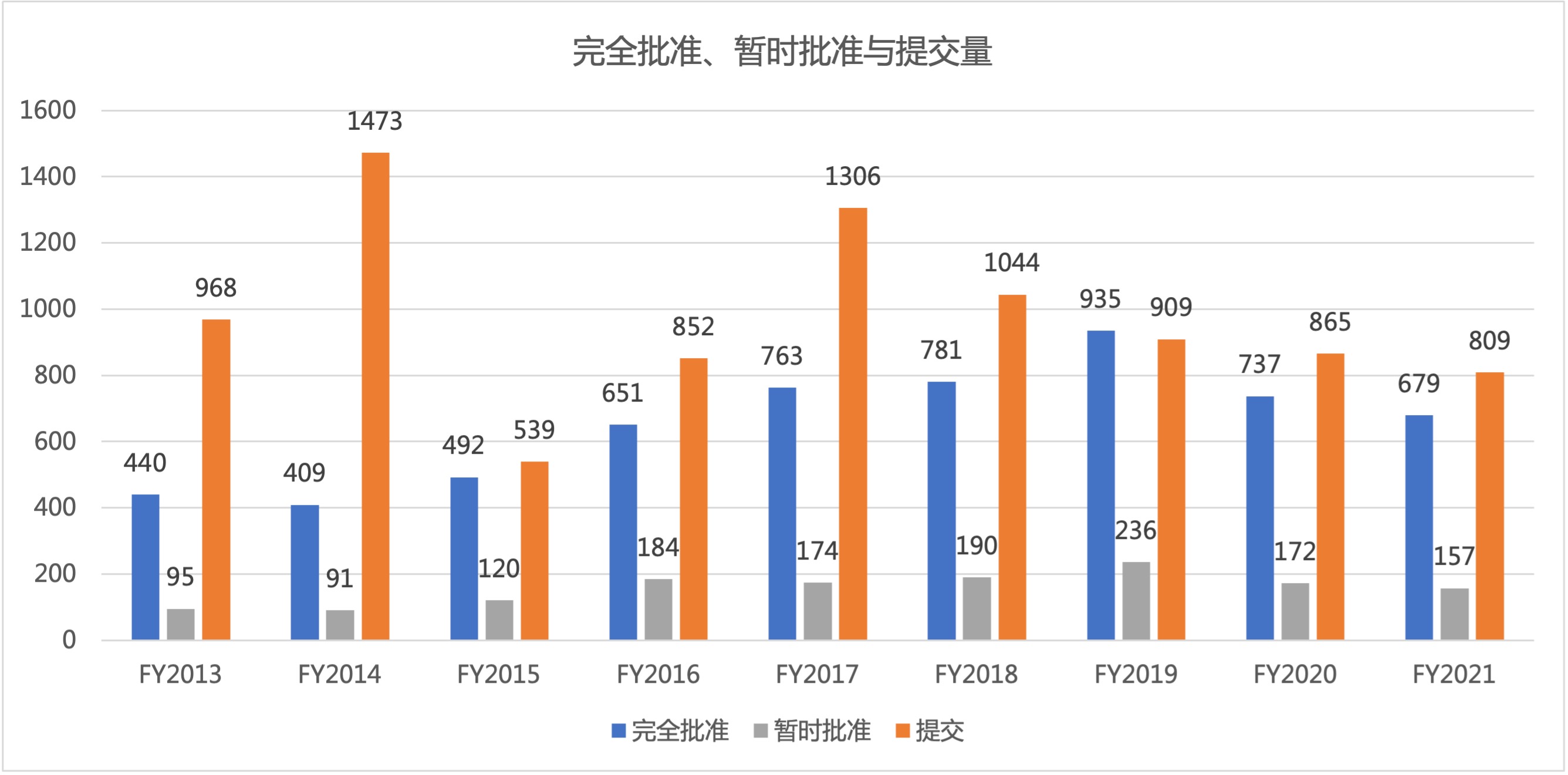
FDA 2021 财年仿制药批准数据趋势与分析
2021.11.09
美国 FDA 仿制药办公室(OGD)公布了 2021 财年全部仿制药使用者付费(GDUFA)批准数据。2021 财年 FDA 报告了 679 件完全批准,这是自 2016 财年(650 件批准)以来最低的年度总数(见图 1)。2021 财年的批准总数比 2020 财年减少 58 件,比 2019 财年(935 件,创...
|

|
FDA 发布 GDUFA III 承诺函,增加对适用性请愿和...
2021.11.04
随着仿制药使用者付费修正案第三次迭代(GDUFA III)谈判的完成,美国 FDA 公布了其承诺函,其中列出了绩效目标和计划的改进。
GDUFA III 承诺函几乎是五年多前发布的 GDUFA II 期承诺函的两倍。FDA 在承诺函中写道,“该计划的新改进旨在最大限度地提高每个审评周期的效率和...
|

|
FDA GDUFA III 期会谈完成:收费将用于资助检查、...
2021.09.06
美国 FDA 和行业代表已就 2023-2028 年的仿制药使用者付费法案重新授权(GDUFA III)达成协议,其中将包括加强有关检查的沟通,以及对“即将批准”的简化新药申请(ANDA)的进一步澄清。
FDA 于 9 月 2 日表示,GDUFA III 谈判已经完成,行业和 FDA 利益相关者之间的批...
|

|
FDA 公布 2022 财年仿制药和生物类似药收费费率
2021.07.30
美国 FDA 于 7 月 27 日在《联邦公报》上分别公布了仿制药使用者付费项目(GDUFA)和生物类似药使用者付费项目(BsUFA) 2022 财年(2021 年 10 月 1 日至 2022 年 9 月 30 日)的费率。下面我们分别来看看。
GDUFA
GDUFA 的费率整体有所上涨,但幅度不大。最大的增...
|