
|
识林公开课:GMP迎检工作分析及注意事项
2022.04.20
随着我国新《药品管理法》、《疫苗管理法》及配套法规颁布和实施及加入ICH、并申请加入PIC/s等国际组织,强化事前审批和事中事后监管的新模式的同时,着力推动监管法治化、制度化、智慧化、国际化。对上市许可持有人依法开展药品全生命周期的监管,夯实主体责任,确保药品安全。
同...
|

|
PICS 修订 GMP 指南反映新的欧盟临床试验法规
2022.02.04
国际药品认证合作组织(PIC/S)于 2022 年 2 月初修订了其 GMP 指南(PE 009-16),以反映新的欧盟临床试验法规(CTR),该法规经过多年延迟后于 2022 年 1 月 31 日生效。
具体来说,PIC/S GMP 指南的附录 13 与研究性医药产品的生产有关,被新的欧盟附录 13 所取代...
|
|
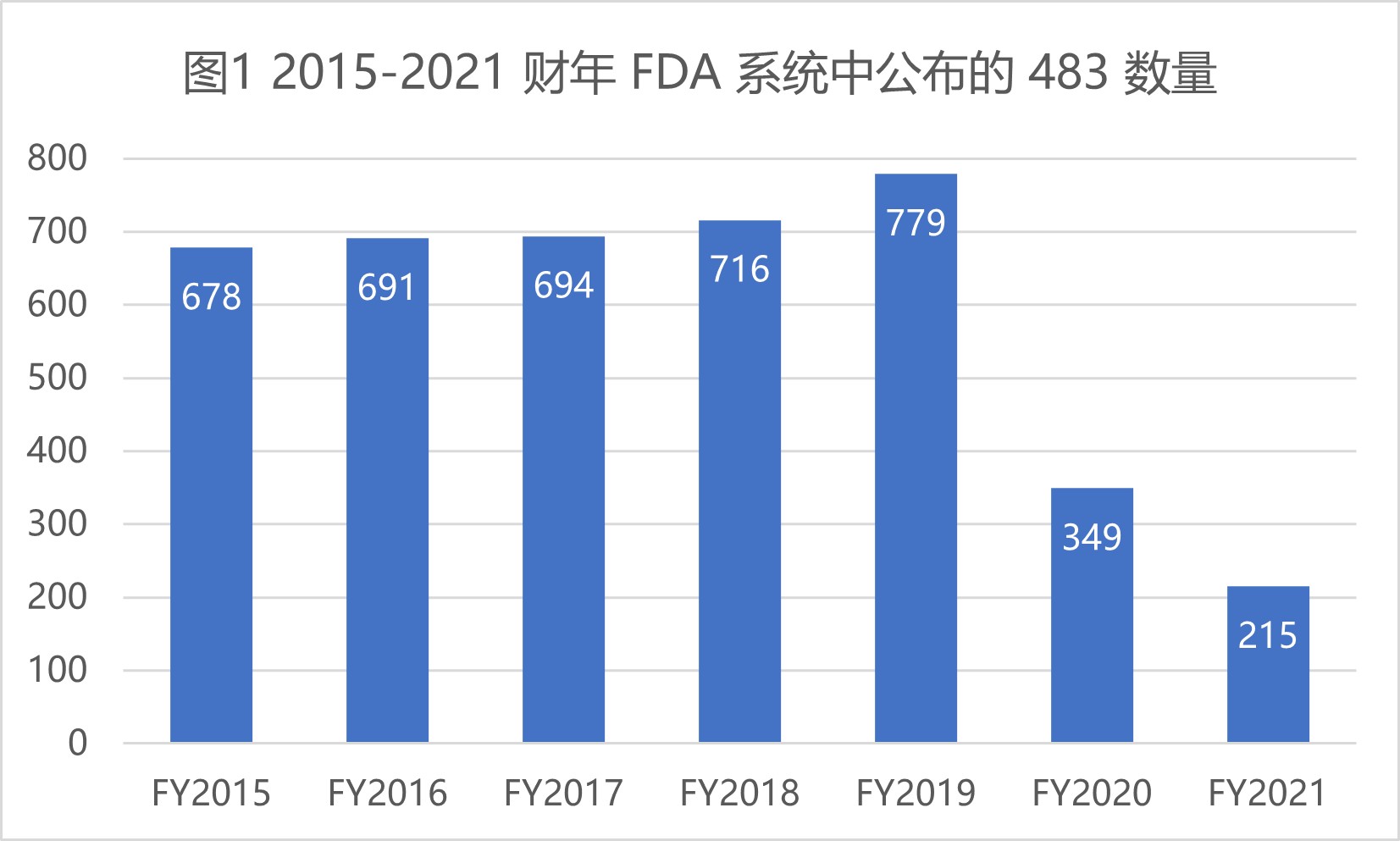
FDA 2021 财年药品检查观察项和趋势
2021.10.21
美国 FDA 于 2021 年 10 月 18 日最新发布了 2021 财年检查观察项汇总数据,本文重点查看药品制剂方面的 483 相关缺陷数据。
由于新冠疫情继续在世界绝大多数国家和地区肆虐,2021 财年 FDA 执行的检查数量仍然有限,而且执行的检查大多也是针对关键任务,涵盖面有限。所以...
|

|
欧盟因新冠疫情继续延长 GMP 和 GDP 证书有效期
2021.10.04
由于新冠疫情继续给 GMP 和 GDP 现场检查带来困难并且为了最大程度减少因新冠疫情对药品生产和供应造成的干扰,欧盟监管机构已将现有证书和限时许可的有效期延长至 2022 年底。这是欧盟自疫情以来第二次延长 GMP/GDP 证书有效期。【欧盟和英国在疫情期间放宽部分 GMP 要求 2020/04...
|
|
ISPE 会上关于数据可靠性、欧盟无菌附录以及常见 GM...
2021.09.29
国际制药工程协会(ISPE)9 月 24 日举办的生物技术会议和研讨会的一个小组讨论会上,澳大利亚监管机构检查负责人分享了有关数据可靠性、欧盟 GMP 附录 1,以及影响受监管制药行业的其它问题的看法。
数据可靠性问题
在小组讨论上,监管机构被要求评论虚拟审计如何影响他们在...
|

|
FDA 发布蛋白原液生产企业监督检查指南手册
2021.08.31
美国 FDA 于 8 月 27 日发布了新修订的合规项目指南手册《CPGM 7356.002M 蛋白原液生产企业监督检查》,该修订版 CPGM 将于 2021 年 10 月 1 日实施,届时将取代 2015 年相同编号的《许可生物治疗药品的检查》指南手册。
CPGM 是 FDA 指导检查员的工作手册,其中包...
|

|
欧盟更新 MAH 和 GMP 法规体系思考性文件
2021.07.31
欧洲药品管理局(EMA)于 7 月 27 日发布了 GMP 和 MAH 思考性文件“Reflection paper on Good Manufacturing Practice and Marketing Authorisation Holders”,规定了根据欧盟委员会(EC)GMP 指南和其它欧盟立法,上市许可持有人(MAH)负有的 GMP 责任,系统梳理了欧...
|

|
PICS 将纳入欧盟 GMP 附录 16 质量受权人认证和...
2021.06.22
6 月 15 日,国际药品认证合作组织(PIC/S)宣布了其将欧盟 GMP 附录16 关于药品质量受权人(QP)认证和批次放行的内容纳入 PIC/S 指南的计划。目的是让非欧盟/欧洲经济区(EEA)成员将附录 16 纳入其监管体系。
欧盟附录 16 涵盖了 QP 的认证,QP 可以为在欧盟的上...
|

|
礼来内部调查报告称没有向 FDA 做出虚假陈述
2021.06.15
据路透社上周报道,根据 5 月 20 日礼来公司 Branchburg 工厂负责人发给员工的一份内部备忘录称,礼来的独立外部法律顾问调查得出结论,“礼来向 FDA 做出虚假陈述的指控没有得到证实。”
备忘录的结论与礼来 Branchburg 工厂工人最初提出的指控不同。根据此前爆出的一份内部...
|

|
CMO混淆污染致千万剂疫苗报废:FDA 要求报废 6000 ...
2021.06.14
美国 Emergent Biosolutions 巴尔的摩工厂的制造问题持续升级。
根据《纽约时报》于 6 月 11 日的报道,援引知情人士消息,FDA 在花费数周时间对工厂进行检查后,已要求新冠疫苗制造商强生公司及其生产合作伙伴 Emergent 报废 6000 万剂疫苗。另外,FDA 允许大约 1000 ...
|

|
美国司法部介入调查礼来新冠抗体工厂质量控制和文件造...
2021.05.28
礼来公司位于新泽西州 Branchburg 生产新冠治疗性抗体的工厂因质量控制问题和涉嫌篡改文件而备受关注。现在美国司法部(DOJ)已介入调查。
礼来于 5 月 27 日公布提交给美国证券交易委员会的 8-K 披露表显示,美国司法部已向礼来发出传票,要求提供与 Branchburg 工厂有关的...
|

|
礼来爆出内部员工投诉高管造假、FDA 最新检查缺陷等...
2021.05.11
根据路透社 5 月 5 日报道,礼来公司内部的一份投诉显示,其员工控告新泽西州 Branchburg 礼来工厂(该厂主要生产新冠治疗性抗体)的一名高管修改 FDA 要求的文件以试图淡化严重的质量控制问题。
这份未签字的投诉报告于 4 月 8 日在礼来保密的员工投诉系统中提交。投诉称,该高...
|
|
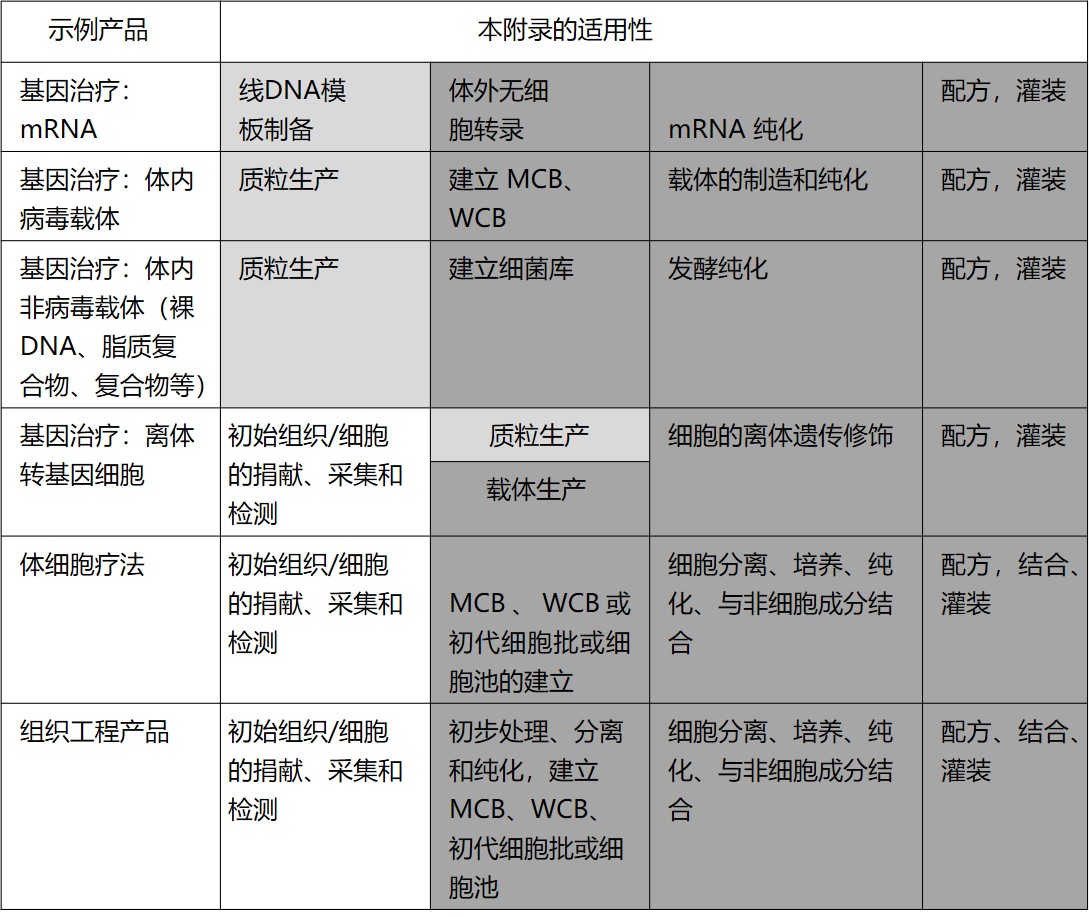
PICS 最新 GMP 指南增加附录 2A 先进治疗药品的...
2021.04.28
国际药品认证合作组织(PIC/S)于 4 月 26 日重新发布了其 GMP 指南,主要修订为将原 GMP 指南的附录 2 《人用生物原料药与药品的生产》稍作修订变为附录 2B,新增附录 2A《人用先进治疗医药产品的生产》。此次修订版本将于 2021 年 5 月 1 日生效。
在生产先进治疗医药产品(Adva...
|

|
FDA飞速检查新冠疫苗CMO并发布长达12页的483
2021.04.22
美国 FDA 于 4 月 21 日(周三)公布了其对 Emergent Bio Solution 巴尔的摩工厂的检查 483,总共 12 页,9 大观察项。
此次 FDA 行动速度之迅速,自上个月底 Emergent 被曝出在生产强生和阿斯利康的新冠疫苗可能存在交叉污染问题,强生将此情况报告给了 FDA。【CMO混淆...
|

|
CMO混淆污染致1500万剂新冠疫苗报废:FDA 关停工厂,...
2021.04.21
美国 FDA 要求 Emergent BioSolution 的巴尔的摩工厂停止生产新冠疫苗原液,并隔离所有剩余产品。
之前,该工厂由于同时生产强生和阿斯利康的新冠疫苗可能存在交叉污染而不得不废弃 1500 万剂强生疫苗原液。之后强生公司将事故报告给 FDA,FDA 对工厂生产线展开调查,同时强生...
|
|
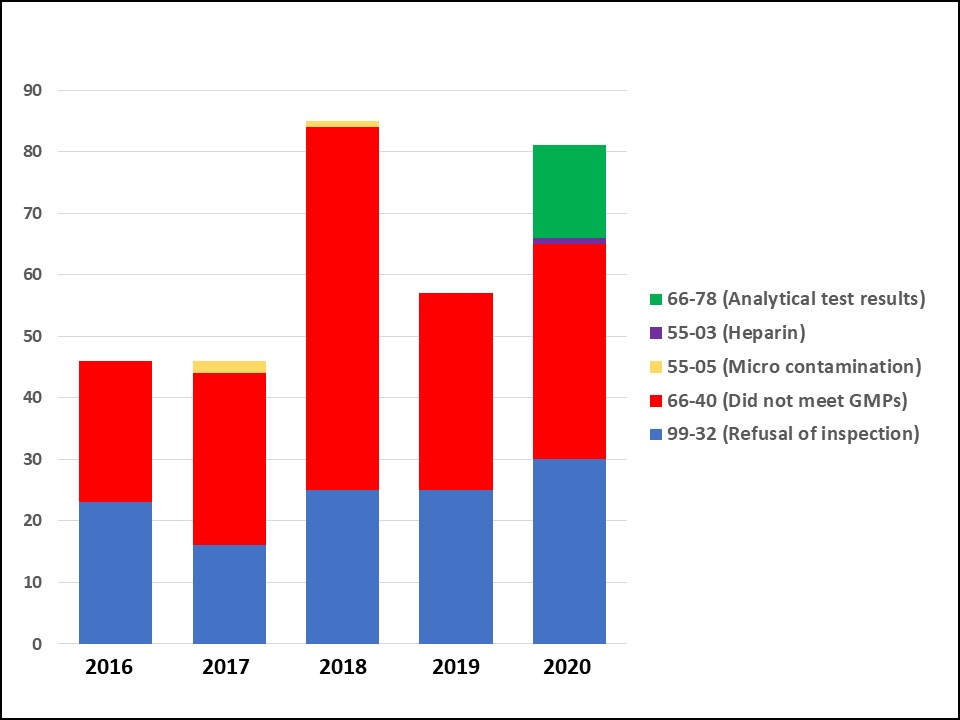
FDA 合规办公室 2020 年报:检查减少,警告信增多
2021.04.05
根据美国 FDA 近期发布的《2020 年合规办公室年度报告》,FDA 药品审评与研究中心(CDER)合规办公室(OC)在 2020 年,由于新冠疫情,检查工作减少,但警告信却有所增多,进口禁令数量也有所增加。
报告还重点介绍了 2020 下半年在办公室活动中占主导地位的新冠应对,包括:保...
|
|
欧盟无菌 GMP 附录修订进展与业界疑虑
2021.03.24
制药行业目前仍对欧盟委员会关于无菌 GMP 附录(Annex 1)的修订有所担忧。行业和监管人员在 3 月 16 日召开的 ISPE 年度无菌会议上介绍了欧盟无菌附录的最新进展,谈到了仍然产生混乱的一些方面并讨论了将受到无菌附录影响的一些领域。
目前讨论的附录修订版于 2020 年 2 月...
|

|
WHO 和国际原子能机构联合发布研究用放射性药品 GMP...
2021.03.10
世界卫生组织(WHO)和国际原子能机构(IAEA)于 3 月 3 日发布了关于研究用放射性药品的 GMP 指南。该指南是对现行研究用产品的 GMP 指南进行修订的首个工作草案,征求意见截止日期为 4 月 30 日,预计将在 2021 年 7 月之前完成修订后的文件并再次公开咨询意见。
指...
|
|
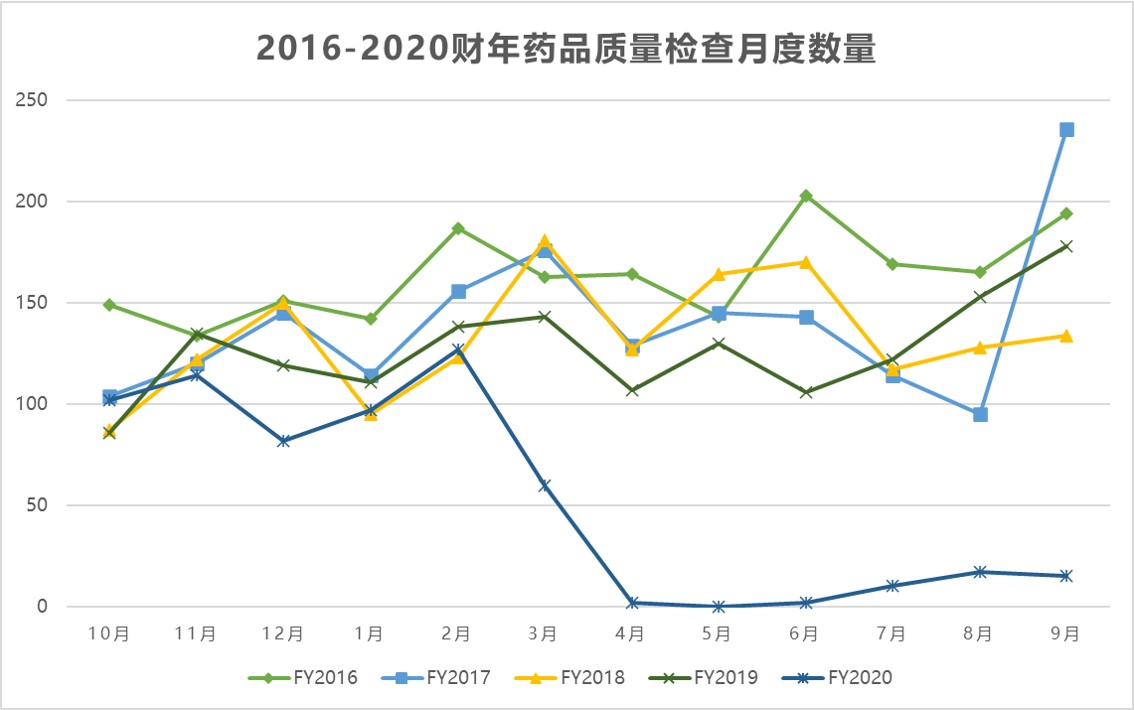
美国 FDA 检查分类情况回顾,做好准备迎接未来的检...
2021.02.12
识林祝大家过年好!牛年第一天我们来回顾一下 FDA 2020 财年的检查分类情况,以及通过这些数据,企业可以提前为未来的检查做哪些准备。
去年,疫情严重影响了美国 FDA 的执法计划,这一影响将在今年持续,并可能波及未来几年。上周识林集中报道了有关 FDA 首封基于远程记录审查的警...
|

|
欧盟检查员分享远程 GMP 检查经验,或将成永久性措...
2021.02.03
在正在进行的试点取得早期积极成果之后,欧洲药品质量管理局(EDQM)计划将“实时远程检查”作为其 GMP 检查计划的一项永久性措施。
这项试点是由于与 COVID-19 相关的旅行限制导致的现场检查的推迟而启动的。到目前为止,EDQM 的检查员已经从他们在欧洲的办公桌旁对印度两家制药...
|