
|
USP容器密封要求:382 661.1 661.2 更新即将生效
2024.04.04
容器密封件的完整性在保障药物制剂的无菌性和稳定性方面发挥着不可或缺的作用。USP通则中的Elastomeric Component Functional Suitability in Parenteral Product Packaging/Delivery Systems、Plastic Materials of Construction 和 Plastic Packaging Systems for Pharmaceutic...
|

|
区分负荷检测与放行检测,USP 提议新通则1119微生物...
2024.01.04
2024年1月2日上线的美国药典论坛(USP-PF)第50卷第1期即PF 50(1)上,USP提议了一个名为“微生物负荷监测(Bioburden Monitoring)”的新信息通则。
注:USP中编号<1000的为强制性通则,一般为通用检测方法或特定的剂型通用要求,在被凡例和各论引用后具有强制性;编号>1000的通...
|

|
USP 与 Phlow 联合组建新实验室支持连续制造发展
2022.12.15
美国药典会(USP)和 Phlow 公司于 12 月 12 日宣布建立战略联盟,在先进药物开发中心开设新的实验室,认证和验证药品连续制造工艺,以期刺激制药行业采用连续制造。
根据联合声明,该联盟将加快 Phlow 对连续制造的应用来生产短缺的基本药物,而 USP 的作用是测试这种制造模...
|

|
应对杂质挑战,USP治疗性多肽和寡核苷酸2022研讨会
2022.06.10
近日,美国药典委员会(USP)举办了治疗性多肽和寡核苷酸在线研讨会,聚焦于了解和应对杂质挑战方面取得的进展。
治疗性多肽和寡核苷酸是快速发展的产品类别,在各种治疗领域具有广泛的发展潜力。然而,多肽和寡核苷酸是复杂的分子,在开发、生产和质量控制方面均面临科学和监管挑战...
|

|
美国药典发布全球药物供应链地图,为药品短缺提供早期...
2022.03.24
美国药典(USP)于 3 月 16 日发布了一份药物供应地图,旨在建立对药物上有供应链的可见性,并识别药品中使用的哪些原料药(API)容易出现短缺。
USP 地图使用来自公共和私人来源的 40 多个数据集和 2.5 亿个数据点的信息来识别全球生产场地,量化上游医药供应链的风险和弹性...
|

|
美国药典会就 mRNA 分析检测指南征求意见
2022.03.04
美国药典(USP)于 2022 年 2 月 23 日发布了新的章节指南,提出了一套分析程序和最佳实践,以加速基于 mRNA 的疫苗和其它治疗药(例如,囊性纤维化和某些癌症治疗药)的产品开发和质量评估。
根据 USP 的公告,USP 和全球利益相关者已了解到对于“分析程序和最佳实践来支持评估...
|

|
USP 亚硝胺杂质章节正式发布,尽力与美国和欧盟监管...
2021.12.08
美国药典(USP)关于亚硝胺杂质的通则章节为评估药物中致癌物质的风险和检测水平提供了指导,反映了与美国 FDA 和欧洲药品管理局(EMA)的仔细协调,以帮助确保监管趋同。
USP 关于亚硝胺杂质的通则于 12 月 1 日正式发布在美国药典-国家处方集(USP-NF)上。USP 于 2020 年...
|
|
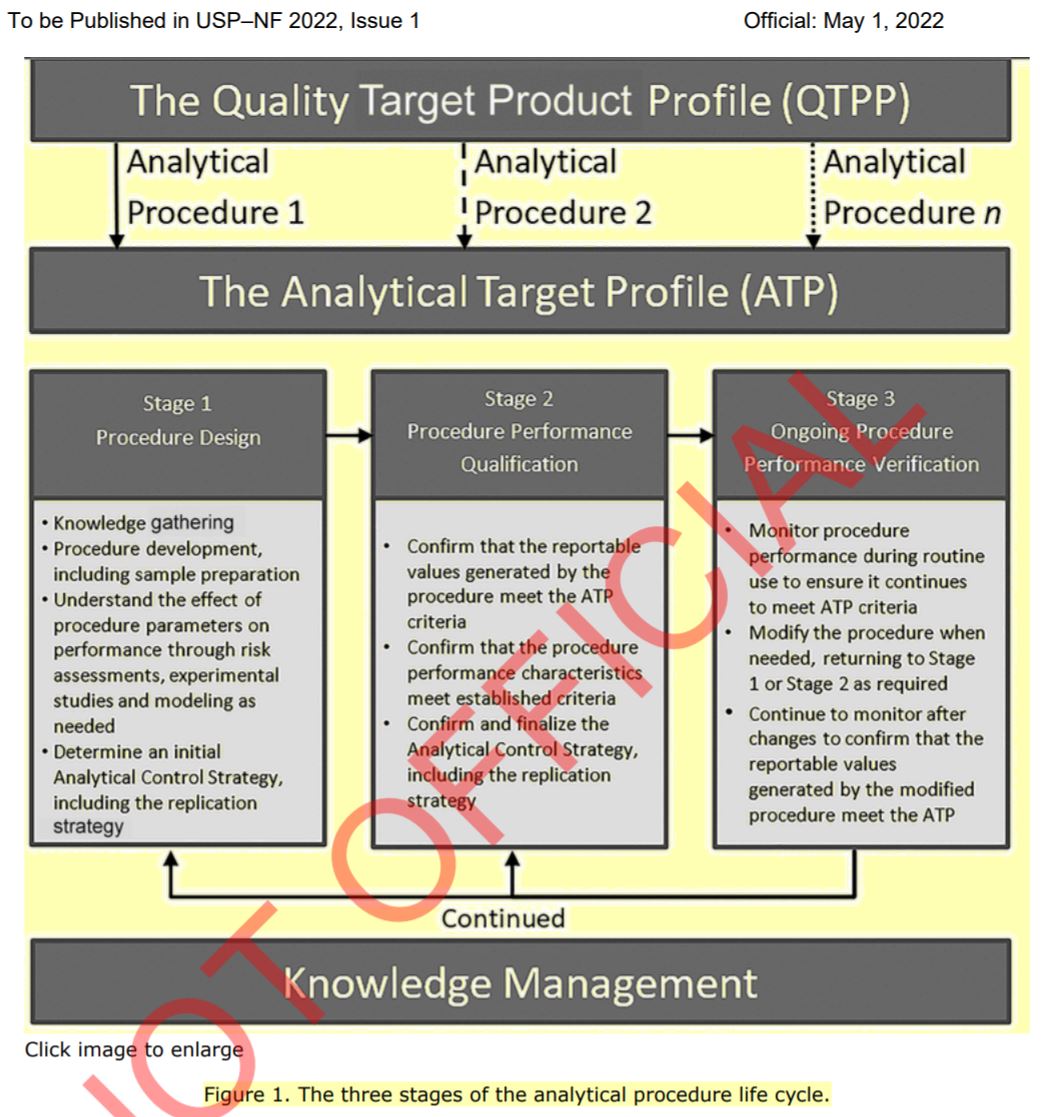
新 USP 通则章节详述分析检验的生命周期方法
2021.10.13
美国药典(USP)最近发布了新的第 1220 章的过程。这一章节将于 2022 年 5 月 1 日正式生效。
USP 章节补充了 ICH 正在制定的 Q14 指南,Q14 有望让制药商更容易的转换分析方法来检测药物。【ICH Q14 分析方法开发草案将于明年初发布,关键信息有哪些?2020/06/25】
...
|
|
美国三大机构开展公私合作提高基因治疗产品病毒载体质...
2021.08.09
美国药典(USP)、美国国家标准与技术研究所(NIST)和国家生物制药创新研究所(NIIMBL)于 7 月 27 日宣布了一项新的公私合作项目,以评估分析方法并制定腺相关病毒(AAV)的标准。AAV 已经成为一种日益重要的基因治疗载体。
根据 NIIMBL 的公告,AAV 对基因治疗特别有用,因为 ...
|

|
业界提议编写目检新USP章节,实现目检的标准化和一致...
2021.06.09
业界一些专家提议美国药典(USP)制定一个新的关于注射用药物目检的协调统一章节,以解决当前的检测空白。这一章节可能将在欧洲药典和日本药典的基础上制定。
根据 5 月 3 日美国药典论坛上发表的一篇促进文章的普遍、一致的定义”。文章的作者包括来自 Genetech、渤健(Biogen)...
|

|
USP 与 Phlow 合建新实验室开发连续制造检测方法和...
2021.03.11
美国药典会(USP)和 Phlow 公司于上月宣布合作建立了一个新实验室,开发连续制造的检测方法和标准,旨在通过帮助使用连续制造的产品开发、技术转移和药品申请申报,以及原料药、中间体和制剂的技术转移后验证,来促进仿制药和其它药品制造商更广泛地采纳连续制造。
实验室由 USP ...
|
|
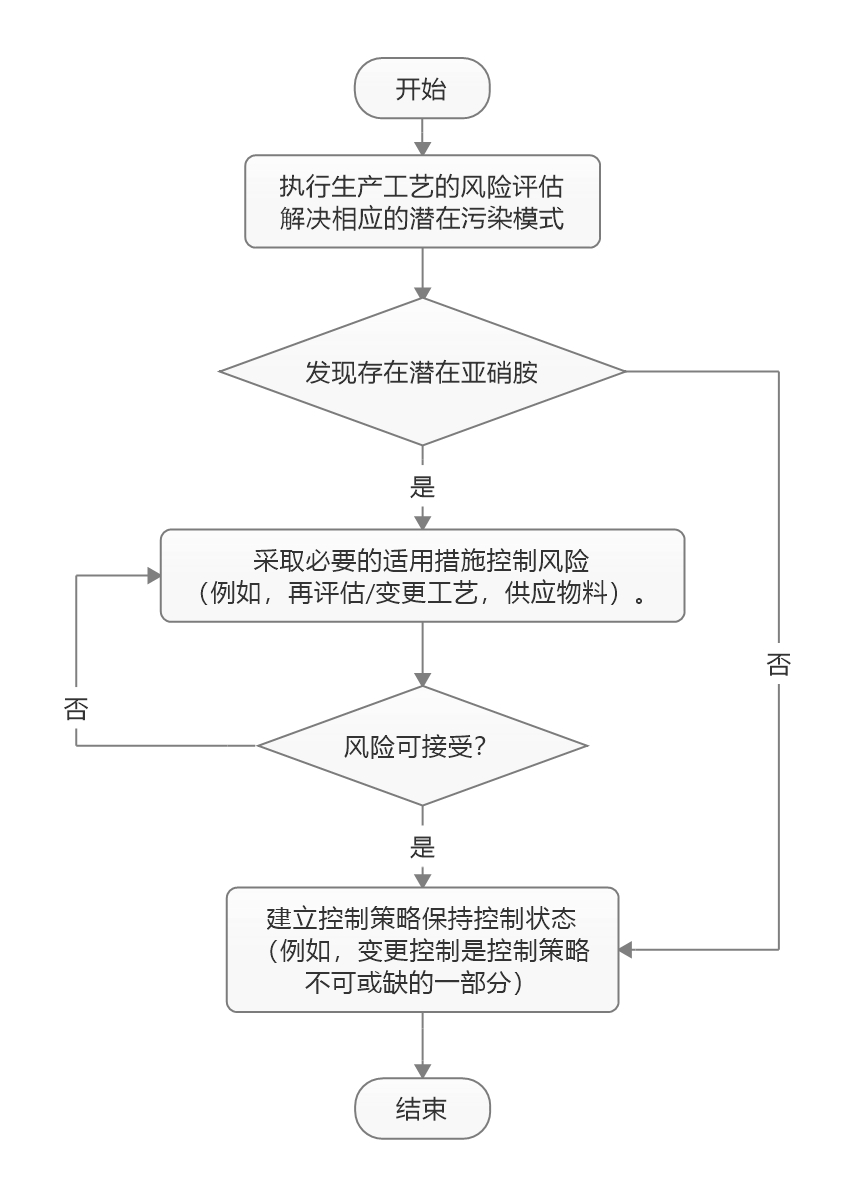
USP 提出亚硝胺杂质新通则章节,列出四种分析方法
2020.09.10
美国药典(USP)已通过提议新的通则章节提出有关如何检测原料药(API)和制剂中的亚硝胺杂质。章节概述了制药商可以用来证明其产品不含不安全水平的潜在亚硝胺杂质的一系列分析方法。
USP 亚硝胺通则章节于 9 月 1 日和 FDA 亚硝胺指南同一天发布,与 FDA 指南的一致之处在于...
|

|
美国药典确定未来五年的 15 个优先事项
2020.09.08
2020 年 5 月,美国药典委员会(USPC)召开网络会议,回顾了其在推进公共卫生方面的核心作用,同时评价了其对 COVID-19 危机迫切需求的应对。会议还通过了 15 项决议旨在设定下一个五年周期的战略重点。
USP 药典委员会会议每五年举行一次,召集有投票权的成员组织代表(现有近 ...
|

|
USP 使用标准品销售数据构建供应链风险模型预测药品...
2020.08.25
美国药典会(USP)正在建立一种风险模型,以帮助利益相关者评估药品供应链中如果不加以防治可能会导致药品短缺的漏洞。该模型基于对 USP 参照标准品的需求程度和地域分布,于今年早些时候启动,以应对 COVID-19 大流行期间的药品短缺问题。
USP 供应链分析高级总监 Vimala Raghaven...
|

|
USP 放弃在内毒素检测章节增加重组因子C,鲎试剂地位...
2020.06.02
重组因子C试剂将作为独立章节收入USP-NF
美国药典(USP) 5 月 29 日发布https//www.uspnf.com/notices/bacterial-endotoxin-test-gen-announcement-20200529 药典通告表示,将天然鲎试剂的合成替代品 — 重组因子 C(rFC)作为独立章节引入 USP-NF 官方文件,...
|
|
从 USP 标准品订单一窥疫情下中印药品生产现状
2020.03.16
美国药典(USP)首席执行官 Ron Piervincenzi 日前表示,中国的药品生产地区从 2 月中旬已经开始从与新型冠状病毒肺炎(COVID-19)疫情有关的旅行限制中恢复,产量已经恢复到正常水平的一半。USP 可以通过检查其参照标准品在中国境内的销售情况来窥探到生产恢复的情况。
他表示...
|

|
FDA 和 USP 就小分子专论更新展开合作加速仿制药批...
2019.07.15
美国 FDA 于 7 月 10 日发布新的指南草案《使用 USP 待审专论程序协调药品申请批准的药典标准》,鼓励需要提请对官方 USP 专论做变更的简化新药申请(ANDA)申办人充分利用 USP 的待审专论程序(Pending Monograph Process,USP-PMP),该指南草案是 FDA 持续支持药品竞...
|

|
USP 基于风险的快速微生物检测
2019.06.27
美国药典(USP)《无菌短效期产品的快速微生物检测:一种基于风险的方法》将于年底生效,一些读者对于这方面的内容多有关注,识林对于该章节内容翻译如下,供读者参考,具体内容还请查阅 USP 原文。
无菌短效期产品的快速微生物检测:一种基于风险的方法
介绍
人们普遍认为,目...
|

|
FDA 公开表示 USP 生物制品标准阻碍创新
2019.06.22
美国 FDA 的主要官员公开发文表示 FDA 对于美国药典(USP)生物制品药典标准的立场并做出解释,认为 USP 生物制品药典标准对于确保安全和质量并不会提供额外保证,并且可能会给审评人员和行业增加负担,减少竞争,限制创新。
美国药典会正在反对一项参议院拟议法案,该法案规...
|
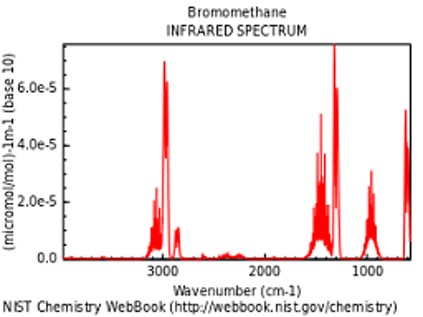
|
简谈新版 USP 光谱鉴别要求变化带来的问题
2019.05.30
新版《美国药典-国家处方集》(USP 42 -NF 37)于今年 4 月 30 日生效之前,USP 章《光谱鉴别检测》规定,“物质的红外(IR)吸收光谱与相应 USP 参照标准品相比,提供可能是任何单一检测中实现物质鉴别的最为确凿的证据。”该章节表示可以对样品和标准品同时分析,并通过比较...
|