
|
多数临床试验披露情况欠佳,大企业比小企业更透明
2021.07.27
最近一项对临床试验透明度的最新研究发现,2016-2017 两年间,只有 26% 的制药商公开了所有用于获得药物批准的研究结果。67% 的药物在获得 FDA 批准后 6 个月内公布了临床试验结果,但只有 58% 符合《FDA 修正案》的临床试验披露要求。11% 的药物在批准时没有公布任何法...
|

|
FDA 代理局长敦促临床研究要走出象牙塔,走进社区
2021.07.12
美国 FDA 在回答新冠大流行会带来哪些变化时,最关心的一件事就是临床试验执行的转变。FDA 高层领导在 7 月 1 日的药物信息协会(DIA)年会上提供了更多关于临床试验执行应该如何发展变化的细节。
FDA 代理局长 Janet Woodcock 在会上表示,她“真正地在推动”在社区进行临...
|

|
欧洲多国监管机构未能确保临床试验数据公开
2021.07.08
由于对临床试验透明度的持续担忧,一份最新报告发现欧洲注册数据库中的临床试验登记库的质量和可用性存在“显著差距”,个别国家监管机构不一致且监管不足。
例如,法国监管机构批准了 1207 项试验,波兰监管机构授权了 831 项试验,但没有出现在欧盟临床试验登记库中。荷兰监管机...
|

|
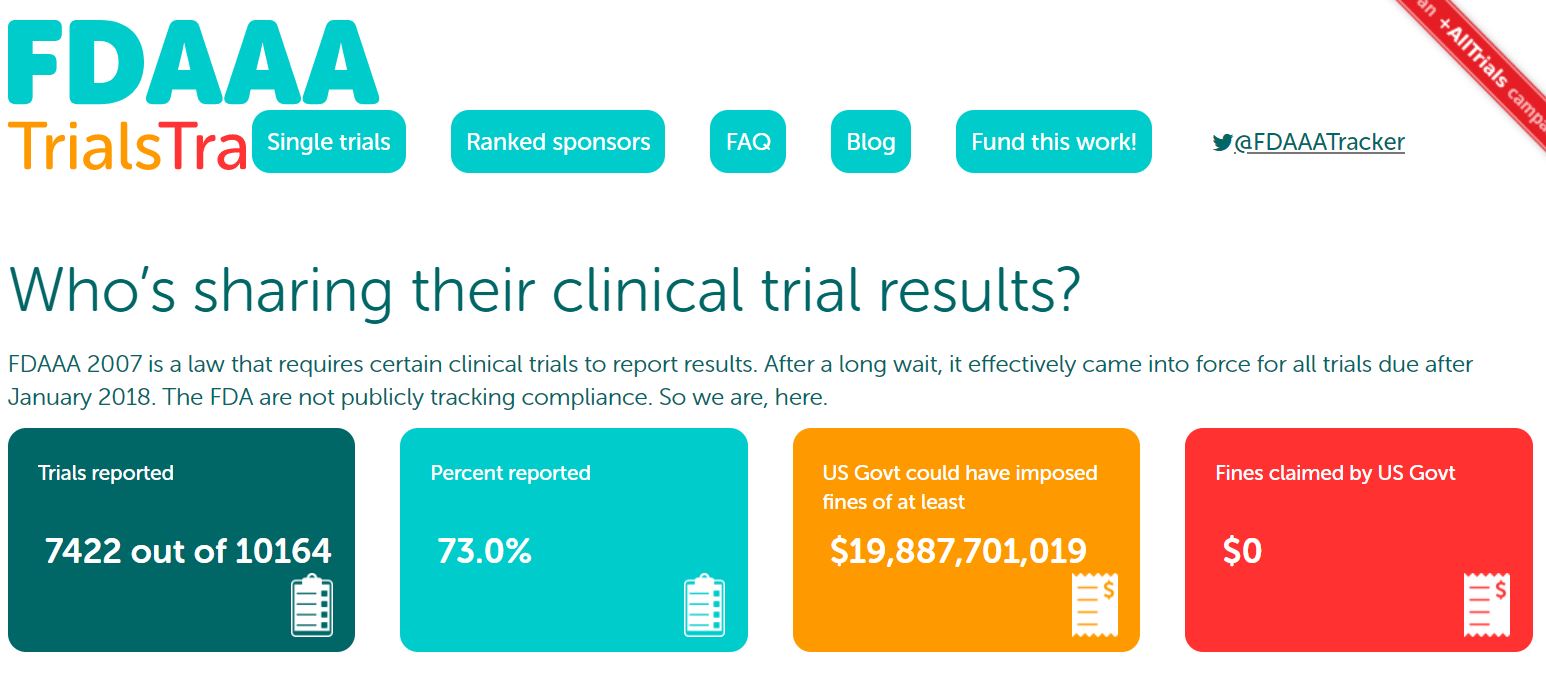
临床试验结果公开初现成效?大多数临床试验仍未能及时...
2021.06.01
随着提高临床试验透明度的呼声不断增加,一项新的分析发现,只有 40% 的研究结果在规定的一年期限内报告给了美国临床注册库 ClinicalTrials.gov。
根据 5 月 24 日发表在《美国医学会杂志·内科学》上的一篇分析1显示,除临床试验结果的报告率较低外,申办人较好地遵守了其它要求...
|
|
临床试验结果公开:三年没公开,收到罚款通知后两天完...
2021.05.28
美国马萨诸塞州的制药商 Acceleron Pharma 在因未能向 ClinicalTrials.gov 报告临床试验结果而面临美国 FDA 首次民事罚款威胁后的第二天,通过发布摘要结果来履行了其法定义务。
尽管 Accelereon 早在数年前就已在其它地方发表了关于 Dalantercept 和 Axitinib(阿昔替尼...
|

|
FDA 发布新冠治疗药和疫苗评估主方案指南,或将影响...
2021.05.19
美国 FDA 于 5 月 17 日发布了题为《COVID-19:评估治疗用或预防用药品和生物制品的主方案》行业指南,介绍了 FDA 当前对开发治疗或预防新冠疾病的药物主方案申办人的建议。
主方案(Master Protocol)的定义为设计有多个子研究的方案,涉及在相同的整体试验框架内的协同努力...
|

|
WHO 和 ICMRA 呼吁提高临床试验数据透明度,不遮掩...
2021.05.12
世界卫生组织(WHO)和国际药品监管机构联盟(ICMRA)于 5 月 7 日发布联合声明,呼吁制药行业在报告和提供临床试验数据方面增加透明度,指出了对于“所有新药和疫苗的临床数据广泛获取”的需求。
与治疗药或疫苗有关的数据“必须在给出监管审评最终决定时公布”,无论决定是肯定的...
|

|
FDA 对未能公开临床试验结果的企业发出首封不合规罚...
2021.04.30
美国 FDA 于 4 月 27 日对未能向联邦注册机构提交临床试验必要信息的申办人 Acceleron Pharma 发布不合规通知,威胁可能会处以罚款。这是 FDA 首次采取罚款措施来回应公众不断要求提高临床研究透明度的呼吁。
FDA 在信中指出,总部位于马萨诸塞州的制药商 Acceleron 公司...
|
|
FDA 代理局长与卫生研究院院长谈新冠疫情给医药行业...
2021.03.15
新冠(COVID-19)大流行之后,生物制药研究将何去何从?美国 Milken 研究所组织了来自联邦机构、非营利组织和制药行业的领导人召开了为期一小时的讨论会,回答了从 COVID-19 学到的经验教训,以及在大流行后生物医学创新是否存一线光明。
美国 FDA 代理局长 Janet Woodcock ...
|

|
疫情加速 FDA 对真实世界数据的使用
2021.01.28
美国 FDA 已推进真实世界数据的使用来应对新冠(COVID-19)大流行,利用这些数据来了解疾病、规划临床试验以及管理医疗产品供应链以预防短缺。
FDA 首席副局长 Amy Abernethy 在 12 月举行的 FDA/CMS 峰会上介绍了 FDA 在大流行期间对于真实世界数据使用的进展。她表示,FDA与 Re...
|

|
新全球联盟推动分散式临床试验的实施
2020.12.15
12 月 10 日,一个新的国际联盟 — https//dtra.org/dtra-launches-to-democratize-and-accelerate-clinical-trials/ 分散式试验与研究联盟(DTRA)启动,目的是解决整个研究界利益相关者在有意义地采用分散式试验方面持续面临的“重大障碍”。目前成员有 50 个组织,包...
|

|
FDA 定稿指南为增强临床试验人群多样性提供建议
2020.11.11
美国 FDA 于 11 月 9 日发布题为《增强临床试验人群的多样性 — 资格标准、入组实践和试验设计》(Enhancing the Diversity of Clinical Trial Populations — Eligibility Criteria, Enrollment Practices, and Trial Designs)的定稿指南,鼓励药品和生物制品申...
|

|
英国 MHRA 发布使用真实世界证据的随机对照试验指南
2020.11.02
英国药品与医疗保健产品监管机构(MHRA)正在制定一系列关于真实世界证据的指南文件,现已发布第一篇关于在随机对照试验(RCT)中使用真实世界证据(RWD)来支持监管申报的指南。之后的系列指南将分别基于不同类型试验设计中真实世界证据的使用来给出建议和期望。
MHRA 表示,最可能考...
|

|
临床试验中关于人工智能干预措施的报告共识标准
2020.09.29
一项新的共识声明“CONSORT-AI 扩展”为涉及人工智能(AI)干预措施的临床试验报告制定了规则。CONSORT-AI 全称为合并的报告试验标准-人工智能(Consolidated Standards of Reporting Trials–Artificial Intelligence)扩展是一项新的报告指南,用于评估具有 AI 成分的干预措...
|

|
重新思考药品监管:加速快跑还是谨慎持重?
2020.09.17
最近在美印商会(USAIC)年度生物制品和医疗保健峰会上,业界讨论了一些有趣且存在争议的内容,关于新冠疫情是否为重新考虑药品监管流程提供了机会。
简化试验,加快监管进程
百康(Biocon)公司董事长 Kiran Mazumdar-Shaw 表示,大流行期间美国的曲速行动(Operation Warp Spe...
|

|
日本癌症中心建立亚洲临床试验网络,推动新型抗癌药的...
2020.09.17
日本国家癌症中心医院(NCCH)启动了一个新的亚洲试验网络,旨在推动新型肿瘤药的早期临床开发,并作为亚洲地区跨国合作的框架。
NCCH 表示,ATLAS((Asian clinical TriaLs network for cAncerS)项目的主要目标包括推进企业申办和研究者发起的关键试验、基因组医学,改善药物...
|

|
国际 CRO 组织发布白皮书和工具包促进分散式临床试...
2020.09.09
国际合同研究组织协会(ACRO)最近发布了一份白皮书和基于风险的框架以及行业最佳实践。由于 COVID-19 大流行,分散式临床试验的重要性日益凸显。
ACRO 希望其文件能够“帮助减轻不确定性,并减少对分散式临床试验模型采纳的由于。”虽然 COVID-19 大流行正迫使临床试验方法实现...
|

|
FDA 定稿指南明确对未能公开临床数据的企业罚款
2020.08.18
美国 FDA 发布了《有关 ClinicalTrials.gov 数据库的民事处罚》定稿指南。指南解决了 FDA 各中心应如何应对违反联邦法规要求,未能准确、完整地登记注册临床试验并在 Clinicaltrials.gov 网站上报告结果的责任方的问题。FDA 各中心包括药品中心、生物制品中心和器械中心。
FD...
|

|
国际监管机构就 COVID-19 治疗药临床试验终点达成...
2020.08.04
随着更多有关 COVID-19 潜在治疗药物的临床试验正在进行中,国际监管机构已就主要临床终点达成一致,终点的可接受性主要取决于所涉及的试验人群是中度至重度感染的住院患者还是轻度感染的门诊患者。
国际药品监管机构联盟(ICMRA)在 7 月 31 日发布的一份最新报告中解释了用于治疗 C...
|
|
FDA 发布指南解决抗肿瘤药研发早期内毒素限度问题
2020.07.31
美国 FDA 于 7 月 28 日发布《在肿瘤药物和生物制品研发过程中设定内毒素限度》的指南草案,解决了肿瘤药物开发中研究用治疗药经常与其它已获批的治疗药结合使用,或与其它研究用药物联合使用的现实问题。指南介绍了 FDA 对于新药申办人在开发与其它已获批药物组合使用或共同开发...
|