|
欧盟正就诺华基因治疗药 Zolgensma 潜在肝损伤问题...
2023.01.18
欧洲药品管理局(EMA)在俄罗斯和哈萨克斯坦两名接受 Zolgensma 治疗的儿童死亡五个月后,正在为医疗保健提供者制定新建议。
EMA 在 1 月 12 日药物警戒风险评估委员会会议之后发表声明称:医疗保健专业人员应及时评估肝功能测试以及/或者急性肝病体征或症状的患者。如果患者对...
|
|
诺华开发 CAR-T 疗法快速制造平台,可将生产时间缩...
2022.12.13
嵌合抗原受体(CAR)T 细胞免疫治疗产品是人类基因治疗产品,其中 T 细胞特异性经过基因改造,能够识别用于治疗目的所需的靶抗原。但是 CAR-T 的制造耗时较长,患者在符合条件后通常需要等待数周才能接受治疗药的输注。对于一些患有侵袭性癌症的患者,他们可能会在等待治疗到来时死...
|
|
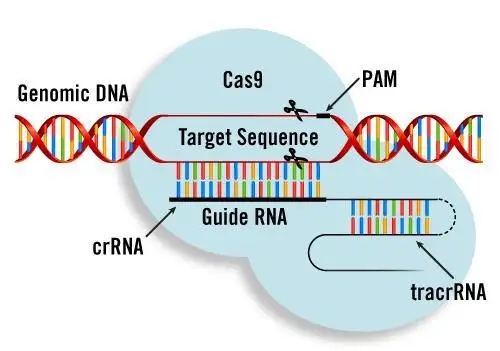
CRISPR 疗法治疗杜氏肌营养不良试验的唯一受试者死亡...
2022.11.07
非营利组织 Cure Rare Disease(CRD)用于治疗杜氏肌营养不良症(DMD)首个人体 CRISPR 疗法在获得 FDA 临床许可的两个月后,该组织宣布试验中唯一的一名患者去世,这名 27 岁的患者 Terry Horgan 也是组织创始人兼首席执行官 Rich Horgan 的弟弟 。
CRD 尽管研究者...
|
|
FDA 神经退行性疾病的人类基因治疗定稿指南
2022.10.25
美国 FDA 于 10 月 21 日发布了“神经退行性疾病的人类基因治疗”定稿指南,为开发相关产品的生物制药公司提供化学、生产和控制(CMC)、临床前研究以及临床试验设计等方面的指导。
该定稿指南以 2021 年 1 月的指南草案为基础,同意了行业反馈的一些要求,包括修改指南中关...
|

|
自然杂志撤稿:诺华重磅 Zolgensma 再现新早期数据...
2022.10.13
诺华重磅基因疗法、脊髓型肌萎缩症(SMA)治疗药 Zolgensma 近日再次受到早期研究数据可靠性问题的挑战,虽然可能并不会影响 Zolgensma 目前的批准和商业销售,但这已是该药自批准以来第二次被发现早期小鼠研究的数据存在虚假陈述。
上周,《自然·生物技术》杂志发现了 Zolgensma...
|

|
先进治疗产品申请喷发员工流失,FDA 细胞和基因治疗...
2022.09.28
美国 FDA 生物制品审评与研究中心(CBER)下的组织和先进治疗办公室(OTAT)主任 Wilson Bryan 近日在美国细胞和基因治疗学会的政策峰会上表示,其办公室负责监管的细胞和基因治疗产品工作量已超过 3000 件活跃的研究性新药申请(IND)。
Bryan 表示,这一巨大的工作量已经使得一些...
|
|
基因治疗与精准医疗:业界呼吁信息共享,期待新研究范...
2022.07.22
23年前,基因治疗领域满载着突破性治疗的希望。随后,一名18岁的临床试验志愿者Jesse Gelsinger在接受了一种用于治疗罕见肝脏疾病的基因工程病毒后死亡,加上基因治疗可能引起的其他危险后果,产生了寒蝉效应,投资者纷纷退避三舍,该疗法因此趋于停滞。
基因治疗的发展需要信息共...
|

|
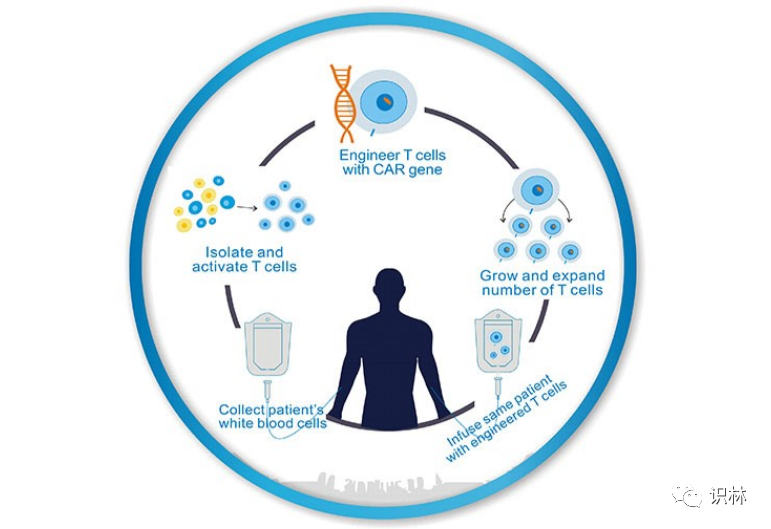
力求趋同,WHO制定细胞和基因治疗产品全球监管框架
2022.07.14
基于细胞、组织和基因的疗法和产品涵盖较广,从相对简单的(例如未加工的自体细胞和组织移植物)到高度复杂的(例如转基因细胞)均有涉及。许多国家已经建立了反映这类疗法和产品的多样性和复杂性的有效的法律框架和法规,以保护捐赠者和接受者的安全。
医疗用人体细胞和组织(HCTs...
|
|
对于细胞和基因治疗产品,与临床研究阶段相适应的GMP...
2022.07.01
细胞和基因治疗产品产业持续发展,从发现研究阶段逐步进入临床开发并过渡到中后期和及商业化生产阶段,产品的质量、合规以及适当的标准成为需要考虑的必要要素,到了是否准备好开始GMP生产的决策点。
在着手考虑这些要素的组织或机构,包括成熟的大/中型生物药企业、初创公司、以及学...
|

|
应对基因和细胞治疗审评的巨大挑战,FDA的OTAT办公室...
2022.06.21
近年来,基因和细胞治疗研究性新药申请和相关会议的爆炸性增长大大超过了CBER属下的组织和先进疗法办公室(Office of Tissues and Advanced Therapies,OTAT)人员的增幅,由于资源限制,OTAT不得不拒绝许多申办者的会议请求。
为了满足领域快速发展带来的需求,提高自己与...
|

|
细胞和基因治疗的生产、临床终点和报销问题,ASGCT ...
2022.05.25
基因疗法领域的前沿国际学术会议——美国基因与细胞治疗年会(ASGCT)于5.16-5.19日在华盛顿特区线下召开。
美国基因和细胞治疗学会(ASGCT)创立于1996年,是一家总部位于密尔沃基的专业非营利性医学和科学组织,提供了一个国际化平台,供从业者们介绍和批判性讨论前沿基因和细...
|
|
FDA对细胞和基因治疗产品的检查和常见缺陷统计
2022.03.30
细胞和基因治疗产品从早期研发逐步过渡到临床中后期和商业化生产阶段。个体化,“活”产品,医疗技术属性特点,使得细胞和基因治疗产品在生产等各环节具有高风险的特点。那么细胞和基因治疗产品在生产设施GMP合规方面高频缺陷如何?根据FDA对17个设施35次检查中签发的观察项发现:...
|
|
FDA 发布 CAR-T 细胞治疗的研发考量指南草案
2022.03.17
美国 FDA 于 2022 年 3 月 15 日发布了令人期待已久的《嵌合抗原受体(CAR)T 细胞治疗的研发考量》指南草案,旨在帮助申办人开发 CAR-T 细胞产品。
该指南的发布自 2020 年起就一直列在 FDA 生物制品审评与研究中心(CBER)的指南计划清单上,但拖到今年才正式出炉...
|

|
FDA 调整关于基因疗法相同性的指南,问题仍然存在
2021.10.01
应利益相关者的要求,美国 FDA 更明确地说明了何时将基因治疗产品视为相同的基因治疗产品,以确定孤儿药认定或孤儿药专营权。但其定稿指南仍留下了未解决的问题,即,产品之间可能形成的“细微差异”。
FDA 于 9 月 29 日发布了《根据孤儿药法规解释基因治疗产品的相同性》指南...
|

|
【周末杂谈】基因治疗的新希望?
2021.07.18
先天性基因缺陷导致的发育性疾病,出生8-9年后还可以修复
周末杂谈,多是谈政策相关的话题,今天换个新的,基因治疗。这方面笔者是外行,是看热闹,但看热闹有时更有兴致。产品研发是生产力,政策是生产关系,为生产力服务。就像看球,球员是生产力,裁判是生产关系。观众的兴奋点通常...
|

|
定价分析机构如何评价高价基因和细胞治疗产品的成本效...
2021.06.22
从表面上看,新药的价格越高,其开发者似乎就越难获得药品价格监督机构 — 临床与经济评价研究所(ICER)的认可。对于快速发展的基因和细胞治疗领域的公司而言,这将使 ICER 的审查成为一个难以克服的障碍,尤其是如果该机构的意见在未来确定保险覆盖范围的决定中具有更大权重的话。
...
|

|
仿制药和生物类似药行业未来应如何在基因治疗领域发挥...
2021.05.29
个体化药物的目标是为单个患者提供量身定制的治疗药物,因此可能并不能直接适应大批量低价的仿制药行业模式。但美国仿制药和生物类似药行业组织 — 普享药协会(AAM)主席兼首席执行官 Dan Leonard 希望仿制药行业考虑这方面的选择。
Leonard 在 5 月 27 日普享药协会年会的...
|
|
全球监管协调是推进超罕见病先进疗法的关键,企业可与...
2021.04.10
随着世界各地区的监管机构都在为大量新的细胞和基因治疗先进疗法(ATMP)申请的涌入做准备,美国和欧盟监管机构相关负责人呼吁在各自的监管领域进行更多协调。根据美国再生医学联盟预测,到 2025 年,每年将有 10 到 20 件新的先进疗法申请。
美国、欧盟、英国和日本的监管机构在...
|
|
协调表征细胞因子释放综合征促进 CAR-T 细胞疗法的...
2021.02.22
根据美国癌症研究之友最新发表的一份白皮书1,表征细胞因子释放综合征(CRS)将是确保免疫肿瘤学领域更广泛的接受先进细胞和基因疗法的关键。细胞因子释放综合征通常出现在新型免疫疗法中,例如,T 细胞抗体桥和 CAR-T 细胞。
美国 FDA 生物制品审评和研究中心(CBER)负责人 Peter ...
|

|
欧盟 2021 年基因疗法申报和批准展望
2021.01.06
全球首次批准的基因治疗药物在 2020 年相对较低,但根据对预期上市许可申请申报和批准决定的分析,这一治疗领域在欧盟市场的活动在 2021 年可能会大大增加。今年可能会有至少五种基因疗法在欧盟首次批准,以及至少三种基因疗法提交监管申报(见文末表格)。
2020 年,由于新冠(COVI...
|