|
FDA 计划发布 CAR-T 治疗产品制造指南
2020.11.09
美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 表示,FDA 正在制定关于 CAR-T 细胞疗法生产的新指南以提供更清晰的监管期望信息。但他表示尚不确定指南什么时候会发布出来。
日前,在遗传工程和生物技术新闻(GEN)举办的题为“生物制造在细胞和生物治疗产品中起...
|

|
基因治疗药 Zolgensma 日本上市审批之路揭示的经验...
2020.10.28
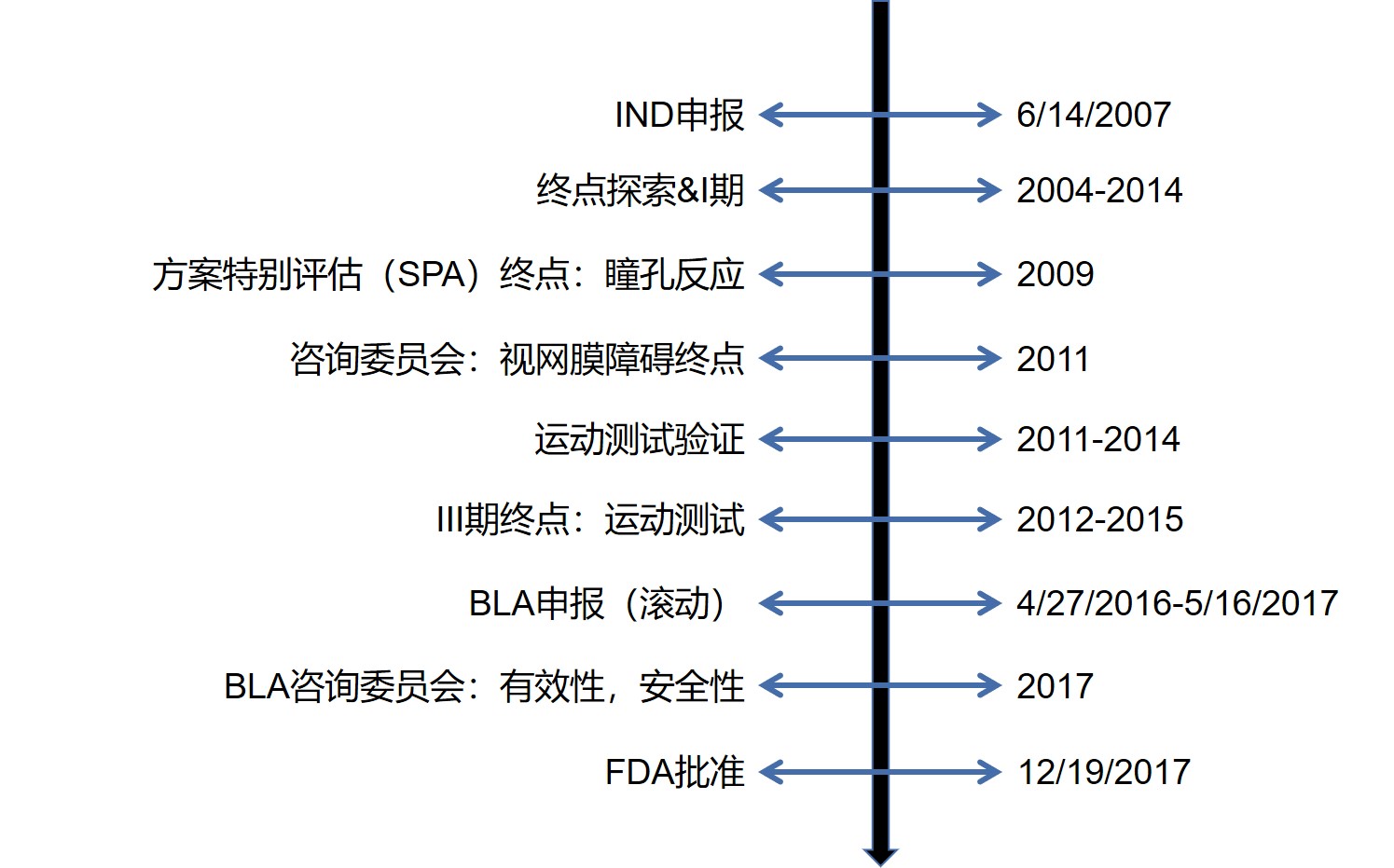
诺华制药新型基因疗法 Zolgensma(onasemnogene abeparvovec)在 2018 年 11 月提交申请后,于今年五月在日本获批。该药用于治疗两岁及以下运动神经元存活基因1(SMN 1)出现双等位基因突变的脊髓性肌萎缩症(SMA 1)儿童患者。
该药在日本获得孤儿药认定和“sakigake”(开拓...
|
|
基因治疗产品相同性判定,业界要求更多澄清
2020.09.05
基因治疗产品开发人员正在寻求美国 FDA 的更多解释,以明确何时出于授予孤儿药认定或专营权的目的,可以将同一类别的病毒载体认为足够不同。
此外,利益相关者希望 FDA 更好地定义细微差异的类型并提供示例,这些细微差异和其它特征会影响 FDA 在孤儿药法规下对“相同性”的确定,并...
|
|
WHO 计划发布细胞和基因疗法监管趋同白皮书
2020.07.09
WHO 计划很快发布白皮书,提出针对细胞和基因疗法的统一监管框架,促进中低收入国家的患者获得这些产品并增加商业可行性。美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 最近在由 PDA 主办的有关先进治疗药物产品的网络研讨会上如是表示。
Marks 在会上还讨论了将...
|

|
基因治疗产品开发瓶颈:缺乏明确灵活的监管框架
2020.06.23
监管者承认缺乏明确的监管框架阻碍了基因治疗产品的开发和加速,而业界则认为监管应该灵活一些以适应产品不断变化的技术。
美国 FDA 生物制品审评与研究中心主任 Peter Marks 于 6 月 15 日在药物信息年会(DIA)在线会议上表示,需要新指导手册来确保对基因治疗产品执行一致...
|
|
FDA 四款获批基因治疗产品及高效开发经验
2020.06.16
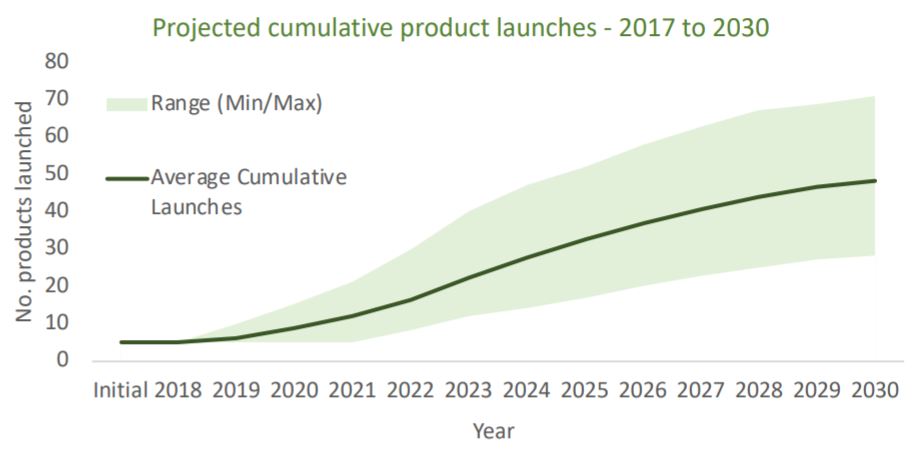
基因治疗的发展得益于科学技术进步,包括2003年10月完成的人类基因组计划(99%的人类基因测序,精确率达99%)、新载体的开发(包括腺相关病毒和慢病毒等)以及基因编辑技术等。图1为2010-2019间提交到FDA的基因治疗产品IND数量,显示了基因治疗产品开发的迅猛发展,2019年共有245项基因...
|

|
FDA 放宽有关罕见病基因治疗药物安慰剂对照试验的限...
2020.04.08
今年1月底,FDA公布了《罕见病基因治疗》(Human Gene Therapy for Rare Diseases)的定稿指南。在指南中,FDA拒绝了利益相关者关于取消安慰剂对照试验的要求,但是通过增加 “当可行时”的前置描述,使这一建议在实际操作中的灵活性有所提高。同时,考虑到业界对2018年指南草案中关...
|

|
个体化基因治疗的开发与监管挑战,NIH 公共平台载体...
2020.04.07
个体化疗法(Individualized Therapeutics)是指通过设计产品解决潜在病症的特定作用机制而专门开发的针对一个或极少数患者的治疗方式。波士顿儿童医院的研究人员已经将这种定制疗法工作推动到了最前沿,他们为一名患有罕见 Batten 遗传病的儿童患者,使用针对患者定制的反义寡核苷酸方法...
|

|
诺华基因治疗药数据操纵问题悄然平息
2020.04.01
诺华子公司 AveXis 因操纵用于 Zolgensma 基因治疗药物批准的数据而引发的数据完整性危机似乎已经悄然结束,美国 FDA 指示 AveXis 公司纠正问题,未施加任何惩罚。
问题的根源是诺华在向 FDA 披露 Zolgensma 的数据操纵方面存在延迟,诺华在 2019 年 3 月 Zolgensma ...
|
|
FDA 一天内发布七份基因疗法指南
2020.01.31
美国 FDA 于 1 月 28 日发布了有关基因疗法开发的六份定稿指南以及一份解释孤儿药法规下基因疗法相同性的指南草案,旨在鼓励制药商将更多药物推向市场,以期刺激竞争,最终降低药价。
自 2017 年以来,FDA 仅批准了四个基因治疗药物,每个药都可称得上是天价药。FDA 最新批准的 AveX...
|

|
FDA 持续大力支持基因治疗产品的研发创新 20200128
2020.01.29
FDA Continues Strong Support of Innovation in Development of Gene Therapy Products
This is a pivotal time in the field of gene therapy as the FDA continues its efforts to support innovators developing new medical products for Americans and others aro...
|

|
识林线下会简报:CAR-T细胞产品的监管路径与合规挑战
2019.11.14
2019年11月11日,识林与Hogan Lovells律所在上海联合举办了主题为“CAR-T细胞产品的监管路径与合规挑战”的线下交流会。君实生物高级副总王刚博士、药明生基医药科技总经理姚树元博士以及Hogan Lovells律所的五位律师出席会议,并为到场的70余位业界人士带来报告,会议由卓见医药联合创...
|

|
FDA 公布诺华对数据操纵问题的 483 回复
2019.09.26
美国 FDA 于 9 月 24 日公布了 诺华公司在 8 月 23 日提交给 FDA 的有关其基因治疗药数据操纵问题的 483 回复。这份长达 59 页的回复函中指出,由于调查的“高度复杂”性而未能尽快将这一问题告知 FDA,并将问题责任归咎于两名 AveXis 高管。
诺华下属子公司 AveXis 公司...
|

|
诺华基因治疗药陷数据可靠性泥淖,知情迟报或加重问题...
2019.08.08
美国 FDA 严肃声明,诺华及其子公司 AveXis 公司可能会面临民事或刑事诉讼,不仅是因为操纵用于 Zolgensma 基因治疗药物批准的数据,更是因为公司在产品批准前就知道了这个问题但并没有向 FDA 披露。
FDA 生物制品审评与研究(CBER)主任 Peter Marks 在 8 月 6日的一份声...
|

|
研究显示脊髓型肌萎缩治疗药价超所值?
2019.03.18
根据一项最新分析显示,两种旨在治疗脊髓型肌萎缩症(SMA)的药品必须制定比制造商期望定价低得多的价格才能被认为是具有成本效益的。这一分析可能会加剧对新疗法成本的持续辩论,尤其是对于那些针对高度选择患者群体的治疗产品。SMA 是一种罕见且通常致命的遗传疾病,影响肌肉力量和身体...
|
|
美联邦医保计划将为 CAR-T 疗法提供全国性覆盖
2019.03.12
根据一项新提案,美国 Medicare 计划(针对老年人和残疾人的联邦医疗保险)将为全国患者支付昂贵的新型癌症治疗药物 — CAR-T 基因疗法。
美国医疗保险与医疗补助服务中心(CMS)于 2 月 15 日发布了一份国家医疗保险覆盖决定提案。提案规定,在治疗符合一定标准的前提下,包括登记(...
|
|
制造环节:细胞与基因疗法面临的下一个大挑战
2019.01.24
随着新型细胞与基因疗法的管线和市场的扩展,药品研发商是时候关注物流链条其它关键方面的问题了:对于复杂的细胞与基因疗法,制造环节成为行业面临的下一个大挑战。随着从较小规模的临床试验转向更大规模的临床试验,接着进行规模化生产实现商业化,受制于载体供应,病毒载体制造可能成为...
|

|
基因疗法与常规治疗的成本效益分析,孰优孰劣?
2018.12.25
根据一项初步分析,两个治疗脊髓性肌萎缩(SMA)(一种罕见且通常致命的遗传疾病,影响肌肉力量和身体运动)的新药可能是有获益的,但似乎定价太高而不被认为具有成本效益。Biogen 的 Spinraza 于 2016 年作为 SMA 首个也是唯一一个改善疾病的治疗药物获得 FDA 批准。但其治疗第一...
|
|
无法获得报销,高价 CAR-T 疗法何以为继?
2018.11.17
【编者按】CAR-T 等基因治疗药物的面世的确振奋人心,但医院在实际使用中也面临着无法绕开的问题:成本。患者希望紧紧抓住这一线治愈的希望,而支付方目前尚不能拿出有效的报销方案。报销问题同时也可能会对这类药物未来的研发产生消极影响。
在 11 月 14 日哈佛医学院举行的个...
|

|
诺华 CAR-T 首次进入英国医保
2018.09.09
英国国家医疗保健体系(NHS)已于 9 月 5 日与诺华就 Kymriah(tisagenlecleucel)达成保险覆盖协议,这标志着欧洲国家首次同意为 CAR-T 疗法提供资金。
诺华在于 8 月 27 日成为首批获得突破性 CAR-T 疗法欧盟上市许可的两家公司之一后不到十天的时间就达成这项协议,成为 NHS ...
|