
|
FDA-EMA 复杂仿制药并行科学建议试点计划进展总结
2024.02.08
美国 FDA 仿制药办公室(OGD)和欧洲药品管理局(EMA)于 2021 年 9 月启动了一项自愿试点计划,以促进仿制药申请人和两个监管机构之间的同时讨论,最终目标是改善患者获得更难开发的仿制药的机会。这项试点计划是 FDA 和 EMA 于 2017 年启动的并行科学建议(PSA)计划的扩展...
|

|
【周末杂谈】说什么与怎么说
2022.11.20
如何有理有据地呼吁FDA制定监管政策的具体实例
如何有效地与国外药监部门交流,尤其是与FDA交流,由于文化和社会的背景不同,是我国出口药企多年来面临的挑战。聘请国外咨询师、咨询公司或律所,是惯常的做法。原则上讲,解决问题就好,管它是第三方还是第四方呢。但对那些不甘于此,...
|
|
业界呼吁 FDA 制定针对复杂仿制药的批准后变更指南
2022.11.16
最近召开的普享药协会 GRx+Biosims 会议的一场闭幕小结会议上,来自美国 FDA 和行业的人员讨论了复杂仿制药的批准后变更问题。
FDA 提供的 GDUFA II 年统计数据显示,略高于 74% 的需事先批准补充申请(PAS)和近 94% 的生效变更(CBE)-30补充申请在首轮获得批准。...
|

|
FDA 局长总结推进复杂仿制药开发的重要举措
2022.09.22
美国 FDA 局长 Robert Califf 在 9 月 20 日主办的“推进仿制药开发:将科学转化为批准”研讨会的主旨演讲上表示,在复杂仿制药方面,FDA 正在寻找评估生物等效性的新方法,并增加与行业的早期互动。
此次研讨会重点关注简化新药申请(ANDA)申报的常见缺陷,包括 GDUFA 关...
|

|
FDA发布复杂仿制药特定产品指南规划,看看自家产品在...
2022.05.27
近日,美国FDA更新页面“即将发布的复杂仿制药研发特定产品指南”。
该页面展示了FDA计划发布的新增或修订的复杂仿制药特定产品指南(product-specific guidance,PSG),体现FDA目前对特定参考上市药物的仿制药产品开发的想法和期望,帮助仿制药企业确定最合适的方法,提供最有...
|
|
2022财年复杂仿制药的研讨会召开:大量问题引行业讨论
2022.05.27
2022财年仿制药科学和研究计划公共研讨会于美国时间2022年5月9日至10日举行,提出了大量复杂产品的问题,以及业界对于FDA促进复杂产品开发、审评和批准的举措的反馈。由于GDUFA III被看作“封闭的大门“(编者注:即相关修订无法纳入GDUFA III),一些外部建议肯定是有益的,但对FDA来说...
|

|
FDA 概述 2022 财年仿制药研究重点,关注复杂仿制...
2021.12.03
美国 FDA 根据利益相关者在 2021 年 6 月 23 日举行的公开会议上的反馈以及收到的关于在该会议上宣布的 15 项拟议研究重点的书面反馈,发布了 2022 财年具体仿制药研究重点的修订大纲。
口服吸入产品也存在各种药代动力学和药效学建模挑战,根据反馈意见,FDA 对 2022 财...
|
|
FDA 复杂仿制药申请日益增长,需分配更多审评资源
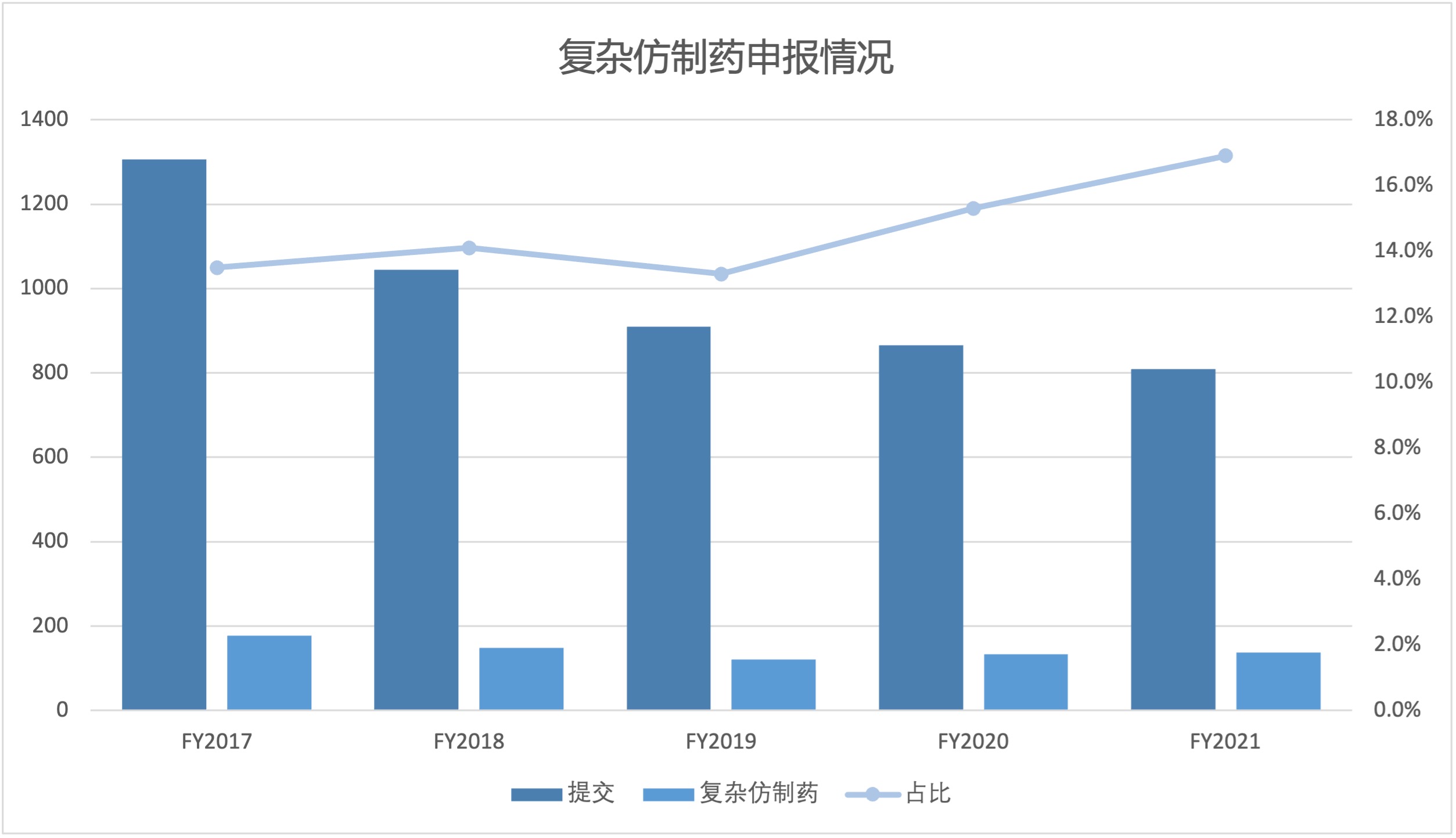
2021.11.24
2021 财年,美国 FDA 复杂仿制药批准占所有简化新药申请(ANDA)批准的 13% 以上,自 2017 财年以来,复杂仿制药批准呈稳步增长趋势。随着复杂产品申请份额逐渐增加,FDA 可能需要调整其内部人员配备和其它资源来适应变化。
美国 FDA 仿制药办公室(OGD)研究与标准办公室 Robert L...
|
|
FDA 重组 DNA 来源的高纯度合成仿制肽指南定稿
2021.05.22
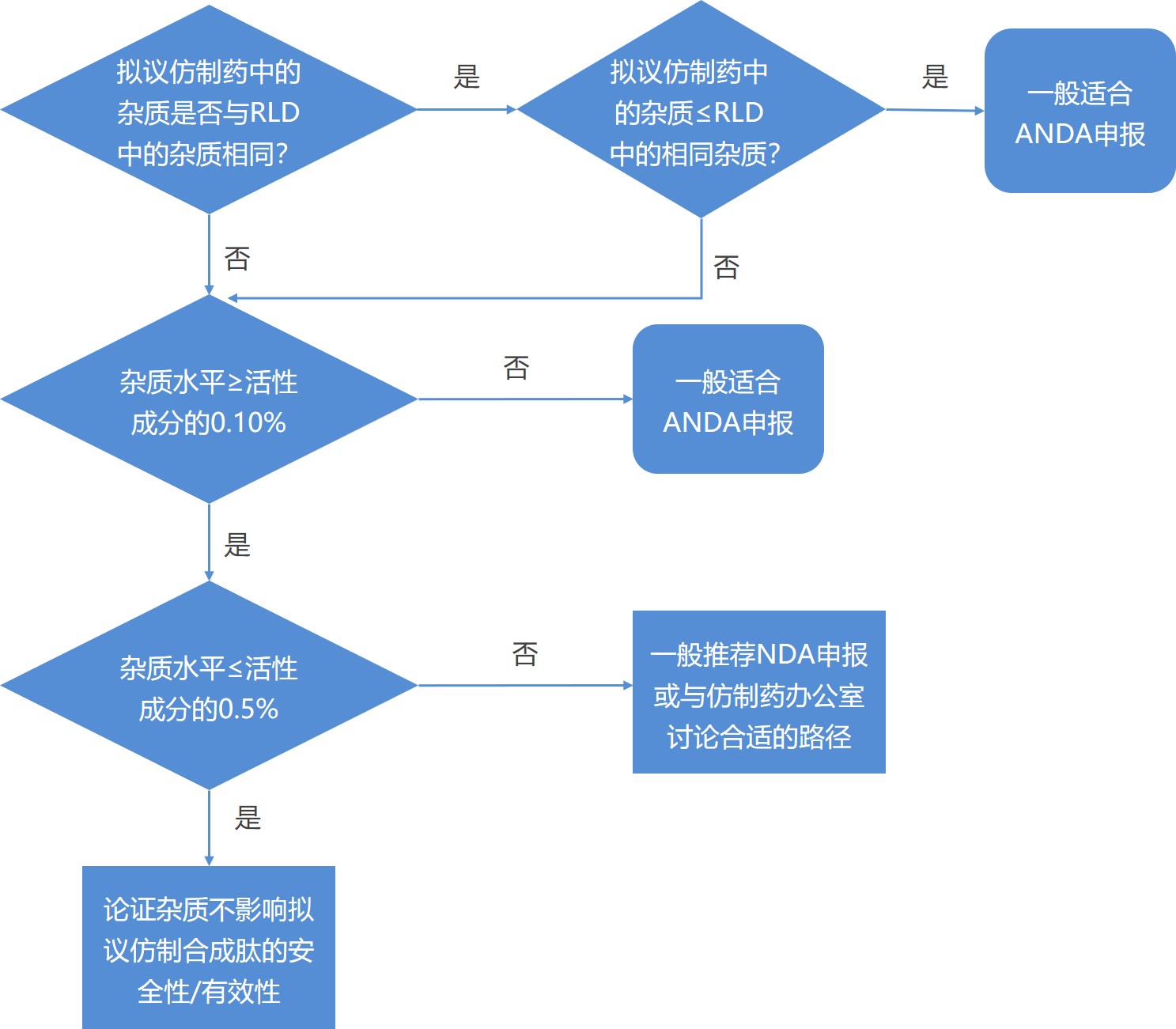
美国 FDA 于 5 月 19 日定稿了《参照 rDNA 来源的高纯度合成肽药品 ANDA》指南。该指南于 2017 年 10 月首次发布【FDA 打开重组 DNA 肽仿制合成的大门 2017/10/05】。
该指南帮助潜在申请人确定针对涉及 rDNA 来源参照上市药品(RLD)的某些合成肽(胰高血糖素、...
|
|
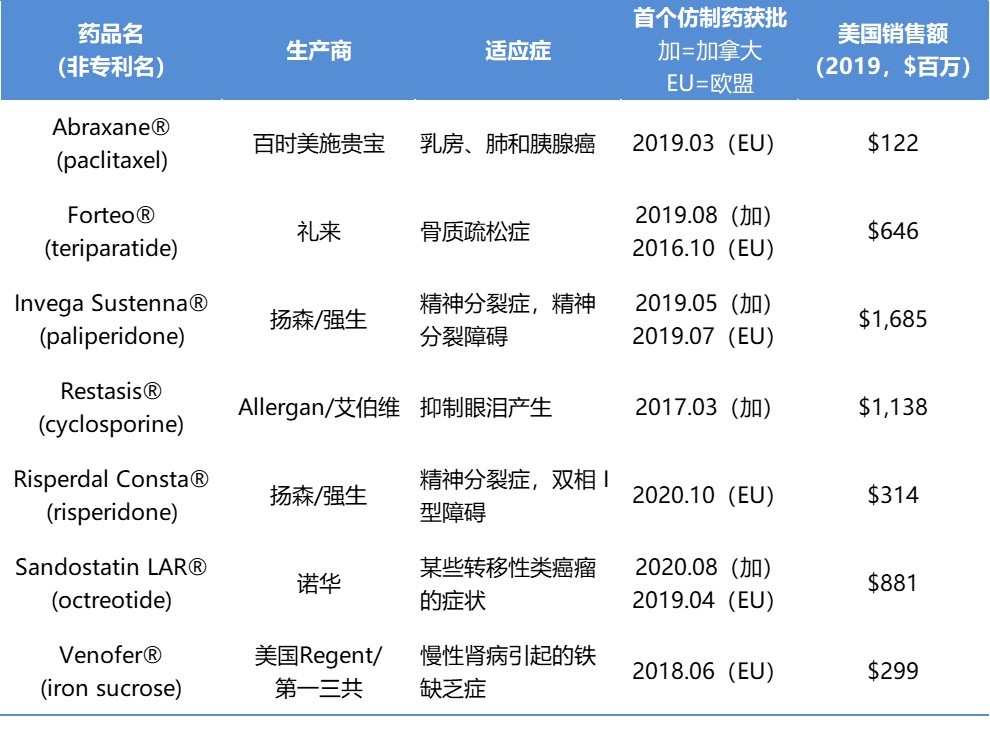
如何加快复杂仿制药批准?业界提出改进建议
2021.02.23
2 月 9 日由美国媒体 The Hill 主办、普享药协会(AAM)赞助的“复杂仿制药和处方药格局”网络研讨会上,业界传达了非常重要的信息,尤其是目前针对仿制药使用者付费修正案 III(GDUFA III)的谈判正在试图加快仿制药办公室(OGD)对复杂仿制药的审批程序。
美国企业研究所常驻研究员 ...
|
|
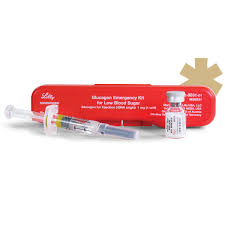
FDA 批准首款合成肽胰高血糖素仿制药
2020.12.30
美国 FDA 于 12 月 28 日批准了美国美药星(Amphastar)公司的首款仿制注射用胰高血糖素 USP 1mg/瓶(急救药盒),用于治疗可能发生于糖尿病患者的严重低血糖症(极低血糖)。该药还可在当需要减少肠蠕动时,在胃、十二指肠、小肠和结肠的放射学检查中作为诊断辅助药物。
FDA...
|

|
FDA 发布复杂仿制药开发和申报正式会议定稿指南
2020.11.26
美国 FDA 于 11 月 25 日发布了《GDUFA 下复杂产品 ANDA 申请人与 FDA 之间的正式会议》定稿指南,概述了产品研发、申报前和中期审评会议三种会议类型、何时举行、申请和开会程序等。
指南通过在简化新药申请(ANDA)开发和申报过程中一步步指导复杂仿制药开发人员如何安排与 ...
|
|
FDA 支持建立复杂仿制药研究中心,促进协作研究和培...
2020.10.10
美国 FDA 希望一个由学术机构运营的独立团队可以促进行业对复杂仿制药研究的参与。
美国马里兰大学和密歇根大学将获得为期五年的 500 万美元资助,用于建立复杂仿制药研究中心(Center for Research on Complex Generics,CRCG),旨在“促进创新对话,传播当前对复杂产品和实...
|
|
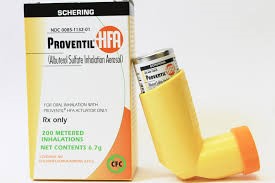
沙丁胺醇吸入器首仿药提前获批,或与疫情期间需求增加...
2020.04.15
美国 FDA 于 4 月 8 日批准了 Proventil HFA(硫酸沙丁胺醇)计量吸入器的首个仿制药,用于治疗或预防 4 岁及以上可逆性阻塞性气道疾病患者的支气管痉挛,并预防该年龄段运动引起的支气管痉挛。Proventil HFA 的原研商为美国默克公司,此次批准的首仿生产商为印度 Cipla 公...
|
|
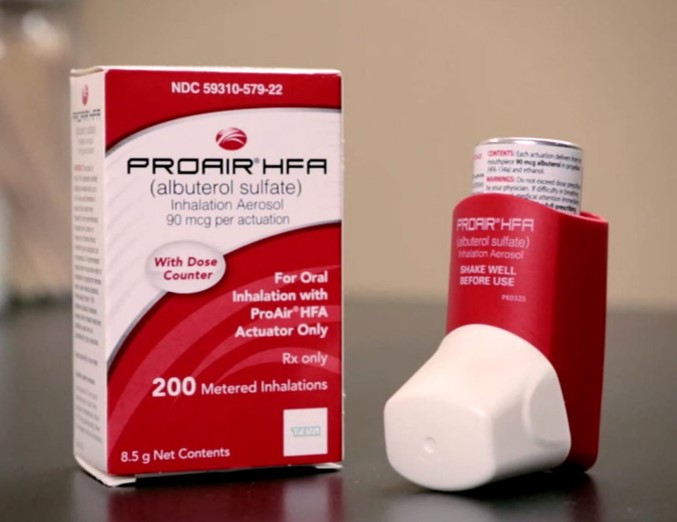
FDA 批准首个仿制硫酸沙丁胺醇吸入剂,国会关注复杂...
2020.02.26
美国 FDA 于 2 月 24 日批准了首个仿制 ProAir HFA(硫酸沙丁胺醇)吸入气雾剂,用于治疗或预防四岁及以上患有可逆性阻塞性气道疾病患者的支气管痉挛,并预防四岁及以上患者运动性支气管痉挛。
FDA 局长 Stephen Hahn 表示,“这是在美国最常用的急救吸入器的首个获批仿制...
|

|
复杂仿制药历史是由参与者书就的
2018.10.02
9 月 5 至 7 日,GRx+Biosims 会议在美国马里兰州巴尔的摩举行,会议的最后一天是 FDA 主持的关于复杂产品 GDUFA II 期 ANDA 前计划的内容。
仿制药办公室(OGD)研究与标准办公室监管事务副主任 Kris Andre 详细讨论了与复杂仿制药会议相关的组织工作和 FDA 的期望。...
|
|
复杂仿制药尚无简单解决方案
2018.09.17
复杂仿制药开发研讨会于 9 月 12-13 日在美国马里兰举行。FDA 仿制药办公室(OGD)主任 Kathleen Uhl 在发表主题演讲时表示,复杂药品对于治疗许多严重病症至关重要,例如,多发性硬化症、精神分裂症、转移性乳腺癌、骨质疏松症、慢性阻塞性肺病(COPD)以及糖尿病。其中一些药十...
|
|
复杂仿制药批准需谨慎,欲速则不达
2018.09.12
【编者按】药监局的基本职责是尽力确保药品标签上的安全和有效性陈述名符其实、让公众感到药品是安全有效的,快审快批其实不是,低价更不是。药监局的公信力离不开自身的职业操守,也离不开全社会的理解、鼓励和支持。
当 EpiPen 的首个仿制药获得批准时,胜利的旗帜在空中飘扬。不...
|

|
公众对生似药与复杂仿制药的接受程度不尽如人意?
2018.08.16
许多文章都曾谴责这样一个事实,即,对生物类似药的使用程度远低于美国 FDA 或业界预期。我已经在这个行业以不同身份工作了 46 年(药剂师、监管者和顾问),见惯了这样的情况。有人说历史再次重演,但今天的观念和力量与 Hatch-Waxman 法案首次颁布时的是一样的。什么观念和力量?...
|

|
FDA 对于吸入和鼻腔仿制药仍需要求临床生物等效性
2018.01.18
美国 FDA 官员表示,尽管对于用体外方法证明口服吸入和鼻腔仿制药的生物等效性进行了有前景的研究,但他们仍然期望仿制药企业用包括临床研究在内的证据权重(weight-of-evidence)方法证明生物等效性。
FDA 在 1 月 9 日举行的https//www.fda.gov/Drugs/NewsEvents/ucm5760...
|