
|
ICH 发布 E2D 上市后安全性数据指南修订草案
2024.02.20
ICH 于 2 月 12 日发布了新的 E2D(R1)"批准后安全性数据:个例安全性报告管理和报告的定义和标准"指南草案,向公众征询意见。
ICH 于 2003 年 11 月采用了 E2D 的第一个版本;指南旨在建立国际标准化程序,以提高批准后安全信息的质量并统一收集此类信息的方式。但根...
|

|
FDA 定稿上市后安全性研究最佳实践指南
2024.02.14
美国 FDA 于 1 月底发布《FDA 工作人员对药品和生物制品上市后安全性监督的最佳实践》,规定了 FDA 对人用药和生物制品进行持续上市后安全监测的基于风险的原则。
文件是根据《21 世纪医药法案》的授权发布的,法案要求 FDA 在其网站上发布这些最佳实践。文件取代了《2007 年 FD...
|
|
FDA正在调查CAR-T治疗后发生T细胞恶性肿瘤的严重风险
2023.11.29
美国 FDA 于 11 月 28 日发布公告表示,正在调查 CAR-T 疗法是否会在极少数情况下导致淋巴瘤(一种血癌)。
FDA 表示,“虽然这些产品获批用途的整体获益继续超出其潜在风险,但 FDA 正在调查已确定的 T 细胞恶性肿瘤风险及所导致的严重后果,包括住院和死亡,并正在评估...
|
|
甲骨文旗下Cerner Enviza公司开发AI工具研究哮喘药孟...
2023.04.13
甲骨文旗下的 Cerner Enviza 目前正在与医疗保健 AI 公司 John Snow Labs 合作开发人工智能工具,以搜索患者记录中是否有哮喘药物孟鲁司特的副作用。孟鲁司特通常用于治疗过敏和预防哮喘发作。
使用基于 John Snow Labs 开发的人工智能模型的自然语言处理技术来理解临床和生物医...
|
|
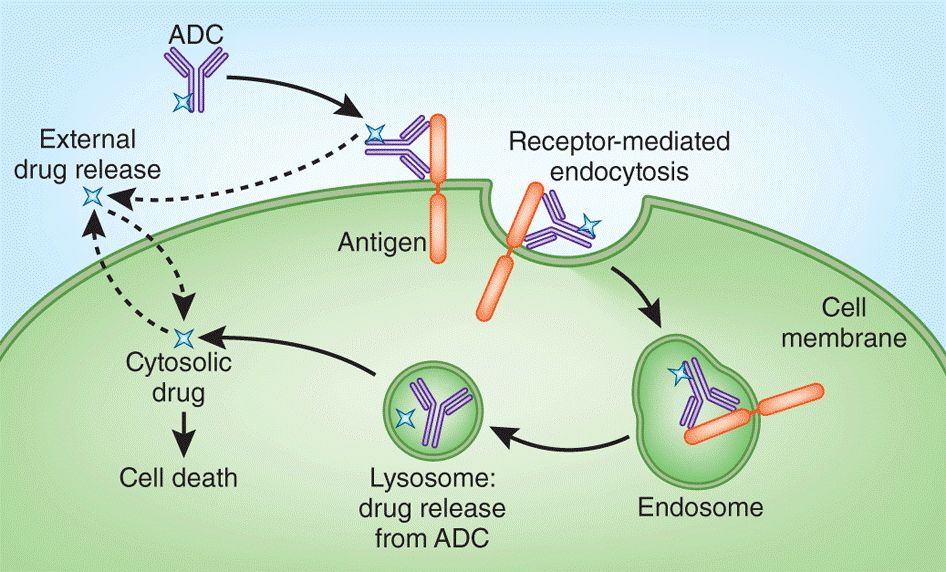
【转载】FDA 对 ADC 药物非临床安全性的审评考量
2021.08.03
近十年来,随着抗体偶联药物(Antibody-Drug Conjugate,ADC)技术的不断完善,ADC上市新药的数量逐渐增加。截至2021年5月,FDA已经批准了11个ADC新药。此外,在超过350个在研项目中,超过60个ADC正处于美国临床II期和III期研究阶段。
由于ADC药物设计的复杂性和多样性,需要考虑抗...
|

|
欧盟宣告阿斯利康新冠疫苗与血栓事件之间存在关联,可...
2021.04.08
欧洲药品管理局(EMA)已经得出结论,阿斯利康的新冠疫苗与在许多使用该疫苗的国家/地区报告的罕见但危险的血栓事件之间存在联系。
EMA 于 4 月 7 日发布公告,其安全性委员会(PRAC)得出结论认为,该疫苗“应将异常的低血小板血栓列为非常罕见的副作用。”前一天已有欧盟官员透露...
|
|
糖尿病药上市前安全性争论不停,FDA 新指南草案受质...
2020.07.21
美国 FDA 于 3 月份发布《2 型糖尿病:评估新药的安全性以改善血糖控制》指南草案向公众征询意见,指南中关于糖尿病药物 III 期安全性数据库的规模和组成引发了业界的担忧。企业认为,指南对 III 期试验安全性的建议过于严苛,并且规模不必要的大,且缺乏正当性。
利益相关者...
|
|
【周末杂谈】新冠紧急情况下用药的一种特殊风险
2020.05.10
同一药的两个品种,单独用都安全,合在一起用,就可能不安全 — FDA 指南
异丙酚(Propofol)是一种出色的麻醉剂,安全、起效快、恢复也快,常用于各种手术,如气管插管和使用呼吸机。在COVID-19疾病救治期间,异丙酚使用量激增,被列入FDA药品短缺清单。
因异丙酚不溶于水,其...
|
|
FDA 发布评估 2 型糖尿病治疗药安全性的新指南,不...
2020.03.11
美国 FDA 于 3 月 9 日发布《2 型糖尿病:评估新药的安全性以改善血糖控制》指南草案,倾向于对目标人群的心血管风险评估进行更长期且更广泛的安全性评估。
新指南草案取代了 FDA 2008 年关于评估 2 型糖尿病药物心血管风险的指南以及 2008 年发布的关于开发治疗或预防糖...
|
|
澳大利亚药监局因商业机密不公开药品安全性警示
2019.03.29
当一个药出现新的安全性问题时,监管机构通常会公开警示,以便让医生和公众知情。美国和大多数欧洲国家基本都是这样做的,而在澳大利亚,有研究发现此类警示出于“商业机密”的原因不予公开。
与其它监管机构不同,澳大利亚药品管理局(TGA)不会将其发给医生的有关新药风险的信件在网...
|

|
FDA 2018 药品安全工作重点与哨兵系统五年计划
2019.01.14
美国 FDA 于 1 月 8 日和 9 日接连发布了两份与安全性相关的报告。一份是《药品安全重点工作报告》,另一份是《哨兵系统五年计划》。2018 年药品安全重点工作报告是 FDA 连续第三年发布的年度报告,报告详细介绍了 FDA 药品审评与研究中心(CDER)去年的安全工作范围。而安全...
|

|
加拿大强制要求制药商报告海外安全监管行动
2018.07.18
加拿大成为首个颁布正式法规强制要求制药商必须在严格时间限内报告在某些国外司法管辖区与其产品相关的安全问题的国家。
加拿大卫生部已经发布https//www.canada.ca/en/health-canada/services/drugs-health-products/drug-products/applications-submissions/guidance-documents/...
|
|
FDA 批准的新药三分之一发现新安全性风险
2017.05.17
根据美国医学会期刊(JAMA)5 月 9 日发布的一项研究(https//jamanetwork.com/journals/jama/article-abstract/2625319 Postmarket Safety Events Among Novel Therapeutics Approved by the US Food and Drug Administration Between 2001 and 2010)显示,在...
|

|
药品审评仅考虑安全性合适吗?
2017.01.06
我们之前曾报道了美国FDA下一任局长候选人情况的各方猜测与讨论【明年谁将执掌FDA? - 识林资讯 2016/12/23】。其中提到作为下一任美国食品药品管理局局长正在被审查的两位候选人之一,风险投资家Jim O'Neill曾于两年前发表演讲,提出一个改革FDA的想法,认为FDA对于新药仅需要安...
|

|
美国路易斯安那州法院向武田制药和礼来开出天价罚单
2014.04.08
由于武田制药和礼来制药涉嫌隐瞒畅销的糖尿病药物吡格列酮(Actos)与膀胱癌之间据称所存在的关联,美国路易斯安那州陪审团日前对这两家公司开出90亿美元的天价罚单(其中武田制药罚金60亿美元,礼来制药30亿美金)。上述罚金数额,超过阿拉斯加法院对1989年埃克森石油公司Valdez油轮泄漏...
|

|
FDA与EMA联手揭开西他列汀与利拉鲁肽安全性疑云
2014.03.03
FDA与EMA联手揭开西他列汀与利拉鲁肽安全性疑云
默克公司的Januvia(磷酸西他列汀)、诺和诺德公司的Victoza(利拉鲁肽)以及其它这类药品正受到关注。在新一轮的安全审评之后,美国与欧洲的监管机构未发现有证据显示广泛使用的肠促胰岛素类似物降糖药会引发胰腺炎或胰腺癌。
由FDA与E...
|

|
近期临床研究显示一降糖药涉及心血管风险
2014.02.20
《新英格兰医学学报》发表的一项研究显示,与对照治疗方案相比,使用沙格列汀(saxagliptin)致使心脏泵血不足,或可导致患者心脏衰竭住院的比率升高。美国食品药品管理局(FDA)已将相关安全信息放入其网站,并要求生产商提供更多数据。
沙格列汀(商品名为Onglyza和Kombiglyze XR)于...
|

|
FDA计划对达比加群开展新的安全性评价
2014.01.07
被誉为60年来最佳的防卒中药物的达比加群,于2008年在欧洲获批,FDA于2010年批准达比加群上市。自上市以来,对达比加群安全性的担心一直挥之不去。FDA目前计划对达比加群的安全性开展新的大规模评价。
2013年12月30日,FDA发布达比加群经选择的安全性结果研究方案,征询公众意见,对新...
|

|
FDA计划要求抗菌皂商家提交效果证明
2013.12.19
FDA于12月16日发布了一份137页的拟议法规,旨在探讨抗菌洗手皂是否比使用简单的肥皂更安全有效。由于对广泛使用这些产品可能形成细菌耐药性的持续关注,FDA正采取措施评估其安全性和有效性。拟议法规不包括在医疗机构中使用的消毒洗手液、湿巾等抗菌用品。相反,该法规针对消费者日常清洗...
|

|
标签安全性变更指南
2013.07.30
概述及内容要点
2011年4月草案发布征求意见;2011年7月,诺华、赛诺菲、BIO、PhRMA反馈意见;2013年7月正式指南发布
介绍、背景、FDAAA下的标签变更实施、程序、争端解决、标签安全性变更实施要求、减少文件工作法案、附录A-新安全性信息来源示例、术语表
再次强调ANDA持...
|