
|
【周末杂谈】标签与监管 – 处方药与 OTC 药
2024.03.17
药品监管的松紧,要与药品的使用联系起来看
处方药和非处方药(OTC),哪个监管得更严?对这个问题的回答,几天前,对笔者来说是显而易见的:当然是处方药严了。新药上市后多年,经过或不经过仿制药阶段,当其安全性和有效性得到了充分确认后,经企业申请和FDA批准,才能成为OTC药。而且O...
|

|
FDA 发布非处方药 NDA 和 ANDA 的年度报告标签变...
2024.03.13
美国 FDA 于 3 月 12 日发布了一篇题为“非处方药(OTC)新药申请(NDA)和简化新药申请(ANDA)可年度报告的标签变更”指南草案,就可能在年度报告中提交的 OTC NDA 和 ANDA 产品标签变更类型提供了建议。
FDA 批准 NDA 或 ANDA 后,申请人可以对已批准的申请进行变更,...
|

|
FDA 允许酸奶企业标称酸奶可降低 2 型糖尿病风险
2024.03.04
昨日,周末杂谈栏目介绍了治疗糖尿病和减肥的前沿医疗器械。今天我们看看美国 FDA 上周五发布的一则关于酸奶降低 2 型糖尿病风险的消息。
FDA 于 3 月 1 日在一封请愿回复信 中宣布,其无意反对使用关于食用酸奶和降低 2 型糖尿病风险的某些合格健康宣称,前提是合格的...
|

|
FDA 发布定稿指南,关于在直接面向消费者广告中提供...
2023.06.29
美国 FDA 于 6 月 27 日发布了关于对人用和动物用处方药和生物制品直接面向消费者(DTC)的促销标签和广告中提供风险和有效性信息的定稿指南。
定稿指南为企业提供有关如何使用“消费者友好”语言,以及如何呈现为药品和生物制品 DTC 编制广告和促销材料的建议,其中包括有关概...
|

|
FDA 发布新的患者用药信息标签拟议规定,帮助提高用...
2023.06.01
美国 FDA 于 5 月 30 日提出了一项新的药物标签规定,旨在让患者更容易理解如何用药,同时提高处方依从性,为制药商和监管机构节约时间和资源。
新拟议规定要求制药商发布一页纸的患者用药信息(Patient Medication Information,PMI),该规定适用于处方药、某些生物制剂以及...
|

|
研究人员敦促 FDA 加强对加速批准药品标签的监管
2023.03.09
最近发表在《药物治疗》(Pharmacotherapy)上的一篇新的分析文章1表明,美国 FDA 加速批准的药物中超 10% 不符合 FDA 2019 年发布的关于加速审批药品标签的指南要求。研究人员指出,缺乏标签透明度会影响处方习惯,呼吁 FDA 通过与制药商开会、发警告信和处以罚款来确保标签合规。
...
|

|
FDA 发布联合用药方案中的交叉标签肿瘤药定稿指南
2022.11.04
美国 FDA 于 11 月 2 日发布了《联合用药方案中的交叉标签肿瘤药》定稿指南,对于被批准用于联合用药方案的肿瘤药标签中应包含的信息提供建议。
肿瘤学中的药物批准通常通过在当前治疗方案中添加药物或通过在联合用药方案中组合研究用药来建立治疗效果,从而创造出更有效的新方...
|
|
【周末杂谈】咬文嚼字:治疗等效性
2022.08.14
对药学等效、生物等效、标签条件等概念的认知
7月20日,FDA发布了“评估治疗等效的工业界指南 (Evaluation of Therapeutic Equivalence – Guidance for Industry)”的征求意见稿,给出了FDA对疗效等效性的最新认知。全文长14页纸,包括:
治疗等效性的基本概念,
FD...
|
|
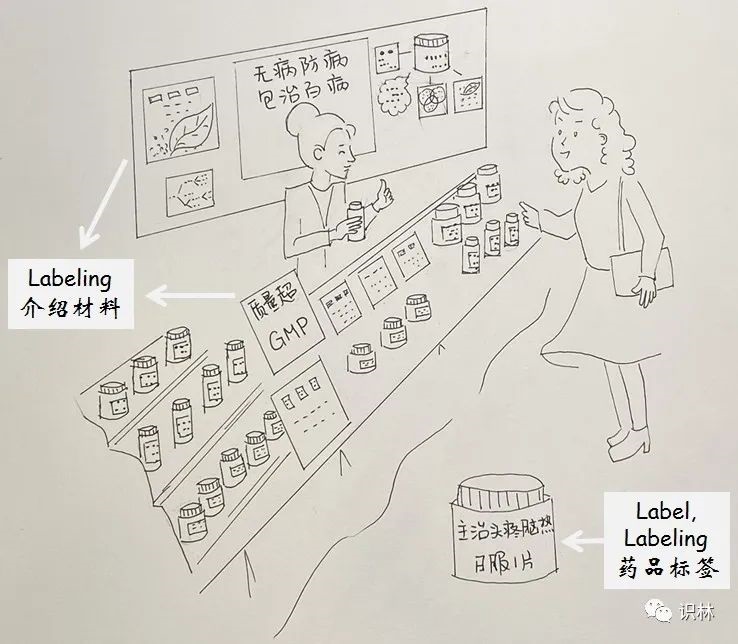
【周末杂谈】咬文嚼字:Label与Labeling的异同
2022.05.01
从法规角度,看对药品标签、说明书、及介绍材料的监管
若要用一句话说 FDA 是监管啥的,那就是监管标签的。可见标签的重要性。在美国《药品法》及 FDA 规章和指南中,常出现两个词,label 和 labeling,中文都可译为标签,但意思有所不同。这不是单纯的翻译问题。美国《药品法》...
|

|
FDA 时隔 20 年更新参照药品标签修订后修改仿制药...
2022.01.27
美国 FDA 于 2022 年 1 月 26 日发布《RLD 标签修订后修订 ANDA 标签》行业指南草案。指南提供了在参照上市药品(RLD)的标签修订后更新简化新药申请(ANDA)标签的建议,包括有关如何识别 RLD 标签更新以及如何对未批准和已批准的 ANDA 提交标签更新信息以符合 RLD 标签更...
|

|
仿制药标签修订和孤儿药专营权成本回收法案美国众议院...
2020.11.20
最近美国众议院全院会议期间通过了一系列法案,其中有两件与 FDA 相关的重要立法:仿制药标签法案和孤儿药专营权法案。
依据《对新标签做出客观药物证据修订法案》(MODERN 标签法案)(H.R. 5668),即使参照产品已经撤市,使得标签处于“冻结”状态,FDA 也可以强制要求变更仿...
|

|
仿制药标签修订新篇章:新法案将以合理方式提供变更路...
2020.07.22
7 月 15 日,美国众议院能源和商业委员会投票通过了H.R. 5668
《2020 年对新标签客观药物证据修订法案》(2020 MODERN 标签法案),该立法概述了当参照上市药品不再销售时进行仿制药标签变更的方法。
关注识林的读者对于仿制药标签变更方面的重要性和问题可能已经不陌生,我...
|

|
FDA 发起多项研究了解处方药广告对患者和医生的影响
2020.07.08
标签和广告是药品监管的重要方面,且直接面向处方者和使用者(用户),只有准确了解用户通过标签和促销材料对药物的理解,才能更好地指导药品研发和监管,让制药商开发出来和监管机构批准的药真正实现预期用途。
美国 FDA 计划开展三项研究以评估处方药促销会如何影响医务人员和消...
|

|
美国拟建连续制造卓越中心帮助仿制药商采纳新技术
2020.03.02
罗格斯(Rutgers)大学教授 Fernando Muzzio 在国会听证会上作证时表示,虽然品牌药公司正在应用连续制造,但其他公司(包括仿制药和非处方药公司)却在为实施连续制造所需的成本和知识而苦苦挣扎。
1 月 29 日,Muzzio 在众议院能源与商贸委员会卫生分委会举行的关于一系列涉及...
|

|
FDA发布有关生物类似物许可和标签以及某些补充申请审...
2020.02.07
FDA Issues Draft Guidance on Biosimilar Licensing and Labeling, Timing of Certain Supplement Reviews
The following quote is attributed to Sarah Yim, M.D., director of the Office of Therapeutic Biologics and Biosimilars in the FDA’s Center for Dru...
|

|
FDA 严禁在宣传标签中暗示生物类似药不如参照产品
2020.02.05
美国 FDA 于 2 月 3 日发布了一份题为《处方生物参照药品和生物类似药的宣传标签和广告考量》的问答指南草案,明确警告在宣传推销活动中不要表示生物类似药比其参照产品劣效或不同。
该指南草案共八个问题解答,这些问题旨在帮助企业在广告或宣传材料中描述产品之间的相似性和差...
|
|
FDA 标签或考虑通过 PKPD 建模分析增加剂量灵活性
2019.08.21
美国 FDA 药品审评与研究中心(CDER)临床科学中心副主任和新药办公室直属办公室高级顾问 Robert Temple 建议 FDA 考虑将药代动力学(PK)和药效学(PD)建模分析添加到药品标签中,以作为指导剂量个体化的一种方式。FDA一般不允许在药品标签中添加未经确证性研究的剂量,而通过 PK...
|

|
FDA 发布两份新指南帮助制药商编写清晰一致的标签
2019.07.03
美国 FDA 于 7 月 1 日新发布两份标签指南文件草案,一份题为《使用说明 — 人用处方药和生物制品以及药械和生物制品-器械组合产品患者标签 — 内容与格式》(用于标准化标签的使用说明部分),另一份题为《人用处方药和生物制品标签的药物滥用和依赖部分》。另外,FDA 表示,...
|

|
FDA 发布加速审批药品说明书的定稿指南
2019.01.28
美国 FDA 于 1 月 22 日发布《加速审批监管路径下批准的人用处方药和生物制品说明书》定稿指南(中文翻译),指南对于替代终点被广泛认可的治疗领域(例如,肿瘤学领域)以及那些替代终点没有被很好地了解的治疗领域分别给出了具体的说明书建议。
指南指出,对于像抗癌药等一些药...
|
|
美总检察长再次就最高法院福善美优先权诉讼案表态支持...
2018.12.22
美最高法院在涉及默沙东公司骨质疏松症药物福善美(Fosamax)案件中的判决,可能会对大型制药公司产生连锁反应。今年 7 月识林曾报道过此事【制药商是否能避免因 FDA 拒绝标签修订而导致的产品责任诉讼】。
今年6月美国最高法院同意听取默沙东公司在长达数年的福善美(Fosamax,通...
|