|
最新研究表明早期使用瑞德西韦可减少新冠住院率
2021.09.23
吉利德(Gilead )于 9 月 22 日表示,其新冠(COVID-19)瑞德西韦(remdesivir)在一项新研究中似乎将在疾病早期诊断出的高危患者的住院率降低了 87%。
吉利德在公司的新闻稿中发布的新结果可能有助于巩固对这种药物有效性的看法,同时还可以提高人们对使用辉瑞和默沙东等制药...
|

|
瑞德西韦新药批准 CMC 审评分析,18 项上市后稳定...
2021.02.24
从美国 FDA 公布的审评卷宗看,在吉利德(Gilead)公司生成有关 Veklury(瑞德西韦)关键原料药和成品制剂批放行和稳定性数据之前,FDA 就批准了该药用于新冠(COVID-19)治疗。
这可能让业界看到一线新机遇:针对其它病症的重要治疗产品有可能在得到所有数据并提交到 FDA 之...
|
|
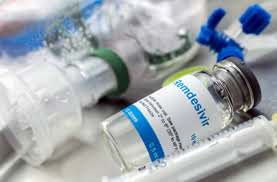
FDA 解释瑞德西韦批准依据,暗驳 WHO 的否定建议
2020.11.27
美国 FDA 于 11 月 26 日不同寻常地发布了一篇关于介绍瑞德西韦批准用于 COVID-19 治疗的安全性和有效性证据的文章,但其主要目的似乎是为了回应公众对于最近 WHO 与 FDA 关于瑞德西韦用于治疗 COVID-19 的相矛盾建议的质疑。
FDA 在文中介绍了 FDA 对于瑞德西韦(品牌名:...
|
|
瑞德西韦:WHO不建议用于新冠治疗,FDA授权与抗炎药联...
2020.11.21
世界卫生组织(WHO)于 11 月 19 日发布的一份修订指南中建议:不要使用抗病毒药瑞德西韦(Veklury,吉利德公司)治疗新冠(COVID-19)。
根据 WHO 指南制定小组表示,“无论其病情严重与否,不建议对 COVID-19 住院患者使用抗病毒瑞德西韦,因为目前尚无证据表明抗病毒药物...
|

|
瑞德西韦带来的优先审评券:烫手山芋?
2020.11.04
吉利德(Gilead)公司的 Veklury(瑞德西韦)于 10 月 23 日获得美国 FDA 正式批准用于某些新冠住院患者的治疗,与批准同时发出的还有一张“重大威胁医疗对策优先审评券”,该审评券旨在为某些治疗、预防来自特定化学、生物、放射和核威胁伤害的医药产品提供额外激励措施。【FDA ...
|
|
FDA 正式批准瑞德西韦用于新冠治疗
2020.10.23
美国 FDA 今日正式批准了吉利德公司(Gilead)的抗病毒药 Veklury(瑞德西韦)用于 12 岁及以上、体重至少 40 公斤的需要住院的 COVID-19 成年和儿科患者,成为首个获得 FDA 正式批准的 COVID-19 治疗药物。
该批准不包括最初于 2020 年 5 月 1 日签发的紧急使用授权(EU...
|

|
瑞德西韦:向 FDA 提交新药申请,与辉瑞合作扩大生...
2020.08.11
吉利德(Gilead)公司的瑞德西韦(remdesivir)是至今为止唯一一个获得监管部门批准用于治疗 COVID-19 患者的药品。瑞德西韦已在欧盟、日本、澳大利亚和英国获得有效条件上市许可,在美国获得紧急使用授权(EUA)。吉利德于https//www.gilead.com/news-and-press/press-room/press-re...
|

|
瑞德西韦:吸入剂试验启动,仿制药最低53美元一瓶,增...
2020.07.10
吸入溶液早期试验启动
吉利德(Gilead)于 7 月 8 日表示,已经开始对瑞德西韦(remdesivir)用于治疗新冠(COVID-19)的吸入溶液剂型进行早期测试。
吉利德表示,这一安慰剂对照试验将在美国招募约 60 名年龄在 18 到 45 岁的健康受试者,为进一步研究奠定基础,尤其是...
|
|
吉利德公布瑞德西韦在美国及部分发达国家的定价
2020.06.30
政府保险每五天疗程价格 2340 美元,商业保险每五天疗程 3120 美元
吉利德(Gilead)公司透露了其备受热议的新冠(COVID-19)治疗候选药瑞德西韦(remdesivir)的价格,可能在某些程度上反映了来自廉价类固醇药物的竞争。
吉利德公司首席执行官 Daniel O'Day 本周一早上在一封https...
|
|
瑞德西韦欧盟获批在即,定价模型修订基准价格有所提高
2020.06.27
吉利德(Gilead Sciences, Inc.)公司的瑞德西韦已在欧盟获得有条件上市许可建议,预计将在下周正式获得批准。根据许可建议,瑞德西韦用于 12 岁以上新冠(COVID-19)重症患者,并且仅限于在可以对患者进行密切监视的医疗机构中使用。上市后,吉利德需在规定时间限内提交最终报...
|
|
英国允许瑞德西韦以许可外用药的方式治疗新冠
2020.05.28
英国药监局给出了这项许可所基于的科学考量
英国药品与医疗保健产品监管机构(MHRA)于 5 月 26 日在早期获取药物计划(Early Access to Medicines Scheme,EAMS)下允许瑞德西韦用于治疗新型冠状病毒疾病(COVID-19)某些重症住院患者。
EAMS 于 2014 年首次推出,其目...
|

|
EMA 表示将很快就瑞德西韦有条件上市许可做出决定
2020.05.19
欧洲药品管理局(EMA)执行主任 Guido Rasi 表示,EMA 可能很快做出决定是否许可吉利德(Gilead)公司的瑞德西韦(remdesivir)用于治疗新冠疾病(COVID-19)患者。
Rasi 于 5 月 18 日对欧洲议会的环境、公共卫生和食品安全委员会(ENVI)表示,“根据所提交的数据以及专家...
|
|
吉利德许可五家仿制药商生产瑞德西韦,产量与覆盖面仍...
2020.05.14
吉利德(Gilead)公司在其瑞德西韦(remdesivir)获得美国 FDA 紧急使用授权(EUA)用于治疗新型冠状疾病(COVID-19)之后,一直在寻找生产合作伙伴以帮助提高产量。5 月 13 日,吉利德宣布已经与五家仿制药生产商达成一系列许可协议,暂免专利费。
吉利德与在印度和巴基斯坦运营...
|

|
ICER公布瑞德西韦两种定价模型,一疗程10美元或4500美...
2020.05.05
- 模型根据两种不同的定价模式估算价格:“成本回收”方法和传统成本效益分析
- 定价估算基于初步数据,随着更多数据的发布以及临床使用的发展以包括早期治疗,定价估算将定期更新;模型还将用于为将来出现的治疗药物提供定价估算
- 瑞德西韦 10 天疗程的初步成本回收价格估...
|
|
FDA 暂时授权使用瑞德西韦的事实说明
2020.05.04
【编者按】授权使用,是行政决定,解释决定的法律及科学依据和考量,不仅是科学监管所应做的,也是对公众和企业的负责,是对 FDA 保护和促进公众健康使命的践行。
美国 FDA 于两天前紧急使用授权(EUA)了瑞德西韦用于治疗新冠疾病(COVID-19)重症住院患者。网上对这一 EUA ...
|
|
瑞德西韦获 FDA 紧急使用授权
2020.05.02
美国 FDA 于 5 月 1 日对瑞德西韦(remdesivir)用于治疗新冠疾病(COVID-19)发布紧急使用授权(EUA)。
该决定是基于两天前美国过敏和传染病研究所(NIAID)宣布的一项临床试验的积极结果,试验结果表明,与安慰剂相比,瑞德西韦缩短了 COVID-19 患者的康复时间。该研究招募了 10...
|

|
众说纷纭:瑞德西韦孤儿药认定的授予与撤销请求
2020.03.26
吉利德(Gilead)公司的瑞德西韦(remdesivir)于本周一获得 FDA 对于新型冠状病毒疾病(COVID-19)适应症的孤儿药认定(只是认定为孤儿药,并未批准该药)引发了人们的广泛关注,今日,吉利德公司发布声明表示,已向 FDA 提出申请,要求 FDA 撤销对瑞德西韦的孤儿药认定,并放弃与...
|

|
同情使用还是临床试验?吉利德暂停个人同情用药申请
2020.03.24
由于同情用药申请需求大增,吉利德(Gilead)公司称将不得不停止对其抗冠状病毒药物瑞德西韦(remdesivir)的个人同情用药申请,将重点放在临床试验和可以收集数据的计划上以评估药物是否有效。
吉利德已为美国、欧洲和日本的数百名患者提供了对研究用药物瑞德西韦的扩大使用(通常会被...
|