
|
四国监管机构检查发现问题,辉瑞暂时关闭其印度工厂
2016.08.09
辉瑞成为最新加入到在印度不断扩大的发现CGMP违规的制药商清单中的一员。6月最后一周,一支由世界四大监管机构检查员组成的引人注目的团队在辉瑞位于印度Chennai附近的工厂发现大量缺陷。辉瑞已暂时停止该工厂的生产,该工厂是一年前辉瑞以170亿美元收购的Hospira单元的一部分。四大监管机...
|

|
EMA更新组织架构建立更加精简高效的体系
2016.07.30
7月29日欧洲药品管理局(EMA)公布了对其组织管理架构一些机构调整和重要的战略修订,从而获得更精简、更高效的体系结构并提高行政管理支持。在2013/2014重组机构的基础上,这些变化微调了重新设计的组织模式,以进一步提供EMA运行效率和有效性。所有的变化将于2016年9月1日生效。
EMA...
|

|
FDA支持在检查过程中分享对于检查员的反馈
2016.07.23
企业每次接受检查都有机会与了解企业合规状态前沿的检查员建立良好的工作关系。如果与检查员出现问题你会怎么办?在第120届食品和药品官员协会(AFDO)年度教育会议上,FDA监管事务办公室(ORA)高级官员被问到了这一问题。业界成员提出针对检查员行为的担忧。首要主题是对于报告检查员在...
|

|
FDA-EU互信倡议 — 为FDA节约检查费用?
2016.07.21
互信倡议(Mutual Reliance Initiative, MRI)由FDA于2014年推出,其目的是“增加FDA与欧盟委员会和欧洲药品管理局(EMA)对保护公众健康决策的关键信息的交流”。
这种隐晦的说法实际上描述了FDA对探索依赖欧洲对欧盟药品设施检查的可能性的兴趣,从而FDA将不需要亲自检查这些设施...
|

|
FDA承诺药品GMP警告信将更迅速简短
2016.07.19
FDA药品GMP警告信将更加简短而要点分明,并将更加迅速地发布。FDA正在编写更加简短的药品GMP警告信以期更迅速地发布出来。FDA正更少的依赖警告信而是更多的依赖合规指南文件传达合规建议来完成这些工作。
FDA关于检查观察项方面正式通知和反馈的延迟,成为业界理解FDA对于其运行的担忧...
|
|
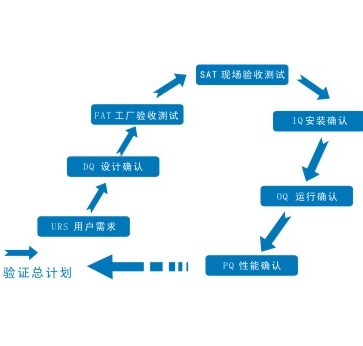
WHO的GMP验证指南及附件全面修订
2016.07.18
目前WHO生效的《GMP验证指南》是2006年的技术报告系列937 (Technical Report Series, TRS)附录4。TRS 937附录4(Annex 4)包括13个章节和7个附件(Appendix)。附件分别是:
附件1:采暖通风与空气调节系统的验证
附件2:药用水系统的验证
附件3:清洁验证
附...
|

|
FDA发布配药商现场检查程序变化公告
2016.07.18
7月11日美国FDA向工业界发布公告,宣布将于8月1日生效对某些人用药配药商的检查程序变化。公告旨在告知美国FDA有关对依照《联邦食品、药品和化妆品法案》(FD&C法案)第503A节寻求配制人用药品的实体(即依据第503B节,未作为外包配药设施在FDA注册的人用药配药商)的检查程序方面的变化。...
|

|
ICH Q11起始物料问答指南草案进展更新
2016.07.16
人用药技术要求国际协调理事会(ICH)正在制定有关原料药生产商起始物料的问答指南,将详细说明申请人需要向监管机构就起始物料提供什么信息,并有望更好的澄清定制化学品(custom synthesised chemical)和市售化学品(commercially available chemical)之间的差异。另外,ICH Q11...
|

|
FDA CDER主任Woodcock谈在FDA供职30周年
2016.07.15
本文整理了Janet Woodcock于2016年7月13日在“主任角 Director's Corner”的与FDA药品审评与研究中心(CDER)沟通交流办公室的Anne Rowzee的访谈。“主任角”是FDA官网网站推出的一个全新的FDA CDER主任音频播客系列。
Anne Rowzee:大家好,我是CDER沟通交流办公室的Anne Rowz...
|

|
FDA对配药房配制已获批药品的指南要求
2016.07.13
美国FDA于7月7日发布两篇指南草案(第1篇,第2篇),澄清了何时允许配药房配制用于销售的药品。尽管联邦法律目前规定配药房通常不应制造已获批上市药品的仿制品,FDA制定了更具体的标准和期望,以确保在已获批药品的配药版本提供给患者之前存在真正的临床需求。
Pew慈善信托基金(一所...
|

|
美国国会质疑FDA保护机密信息的能力
2016.07.12
在对前FDA官员新的内幕交易指控曝光之后,美国国会正在向FDA施压,要求FDA证明对机密信息的保护。
6月24日,众议院能源与商务委员会主席Fred Upton和健康小组委员会主席Joseph Pitts致函。尽管询问的仅是食品部分,但FDA的回复适用于其监管的所有行业。
Upton和Pitt二月份的信函是...
|

|
数据可靠性案例情景剧
2016.07.09
这是一个真实案例。
【背景】
公司是做药物洗脱支架,用于动脉壁,是钛材料做的,插到动脉壁之后血管壁会扩张,但因为是金属材料,会产生排异反应,所以需要药品材料外壁以保证金属材料不直接与血管壁接触,最外层是一层薄薄的聚合材料。在人体中需要3个月的时间释放。
【人物】
...
|

|
FDA项目整合计划:更多问题有待回答
2016.07.08
我们在之前的资讯中曾详细介绍过FDA项目整合小组(Program Alignment Group, PAG)计划的背景和目标【识林资讯 - FDA新检查计划之项目整合小组计划】以及FDA器械人员对该计划的评论【识林资讯 - FDA 监管事务办公室检查项目整合计划正在酝酿巨大变革】。2014年2月时任FDA局长的Margare...
|

|
FDA发布顾问委员会利益冲突“显现”指南草案
2016.07.07
美国FDA表示咨询委员会中的利益冲突显现问题举足轻重。根据联邦利益冲突法不构成回避义务的利益和关系,但可能造成成员缺乏公正性的显现,即显现问题(appearance issues)。
6月26日,FDA首次发布指南草案详细说明了当利益冲突显现可能妨碍某人继续在专家咨询小组服务时的情况。到目...
|

|
EMA总部新址将由成员国协商决定
2016.07.07
7月6日欧洲药品管理局(EMA)发表声明表示,EMA将不会决定将伦敦总部搬迁到哪里,而将会由成员国代表之间通过共同协商决定。
EMA在声明中表示,“EMA欢迎一些会员国表达出未来接纳EMA总部的兴趣。EMA所在地的决定将不会由EMA做出,而是将会由成员国代表之间通过共同协商决定。考虑到英...
|
|
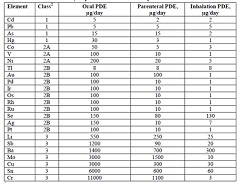
元素杂质要求在欧美的实施时间
2016.07.05
ICH Q3D元素杂质指导原则,适用于化药的元素杂质要求,不适用于植物药、放射药、血浆衍生物、透析液等。
ICH Q3D列出了24种元素杂质的PDE标准(每日允许暴露量)。Q3D 给出了每个元素,如何进行的毒性分析,如何确定的PDE值。并且按照不同途径的毒性试验结果,计算得出不同途径(口服...
|
|
印度计划改写已有75年历史的药品法
2016.07.03
印度撤销了对其药品法的修订提案,决定需要更广泛地改写药品法,以有效监管生物制品、干细胞和再生医学、医疗器械,以及临床试验。
起初,印度政府计划用2013年提出的修正案更新1940年药品和化妆品法。然而,6月22日莫迪总理表示,联邦内阁已经放弃了这一想法,取而代之的是更广泛的修...
|

|
FDA局长:FDA是科学和科学家们的伟大殿堂
2016.07.01
【编者按】有人说FDA才是药业科技创新的主要推手。从局长文章字里行间中对科学和科学家们的尊重上看,这个推手大概非FDA莫属了。
(译自FDA Voice “FDA A Great Place for Science…and for Scientists on the New Frontier of Regulatory Science” 2016年6月23日,作者:R...
|

|
六位FDA前任局长一致呼吁:FDA成为独立内阁机构
2016.06.28
编者按 与美国相比,至少在这一点上,中国启步晚,但走得快。
日前,六位FDA前任局长一致呼吁:让FDA成为一家独立机构,提升其地位。这六位前任局长领导FDA的时间,加起来达32年之久。
FDA目前是美国卫生与人类服务部(HHS)的下属机构。这六位前任局长主张,让FDA成为一个内...
|

|
MHRA考虑退欧影响,BSI仍将作为欧盟认证机构
2016.06.27
英国药品和卫生产品监管机构(MHRA)周一表示仍在努力了解国家脱离欧洲后的全部后果。“在英国脱离欧洲的公投结果出来后,药品和卫生产品监管机构的工作重点一直是公共健康。我们将继续与支持我们的客户、合作伙伴和利益攸关方合作保护健康和改善生活,努力达到最高水平的卓越和质量”MHRA...
|