|
监管科学大会记要:生物药(单抗)企业的FDA检查缺陷...
2023.04.17
2023年4月1-2日第六届中国药品监管科学大会在北京召开,会议共有 14 个分论坛,覆盖了“两品一械”相关领域,药监机构、科学界、医疗机构、制药业以及相关协会代表 1800 余人参加了会议。
在生物制品监管专题研讨会中,识林兼北京大学知识工程与监管科学实验室顾问王国旭研究员做...
|

|
【识林问答短视频】生物制品配液,共线评估,除菌过滤...
2022.11.19
识林提倡“知识导向”,严肃地阅读,系统性听课,需要投入大量时间,从而获取认知层面的提升。当然,企业用户提升认知的目标,还是解决更多、更复杂的问题。
在“问题导向”方面,【识林社区】在向导老师们的支持下,努力做到“有问必答”,而【识林问答短视频】则是从识林数...
|

|
线上讲座:生物制品无菌工艺模拟试验的讨论
2022.08.09
为生物制药生产,在合理的利用微生物,同时控制有害微生物的生长。工艺过程中的特殊性,使其微生物管理要求相对较高,一旦细菌和真菌污染了生物制药的原材料、细胞库、细胞培养和纯化工艺以及最终阶段产品。因此其无菌生产操作尤为重要。培养基模拟灌装试验是无菌药品生产管理的重要组成内...
|

|
FDA将如何审评生物制品?读CBER 的“五年战略规划”...
2022.04.19
近日,FDA的CBER(生物制品评价与研究中心)发布了2021-2025年战略规划。
该规划长达42页,但架构颇为清晰,共分4大“目标”,每个目标又有分解4个子目标,而子目标又对应具体的3到7条实施“策略”。
中国创新药出海已是必要之举,而美国市场是必经之路。随着传奇生物的BCMA CA...
|

|
基因疗法产品监管期待变革,FDA生物制品审评负责人发...
2022.04.08
生物制品评价与研究中心(CBER)主任Peter Marks医学博士近日在《生物疗法专家意见》(Expert Opinionon Biological Therapy)杂志上撰文,公开呼吁对基因疗法的审评与监管采取变革措施,以促进新的基因疗法早日面世。
本文更进一步体现CBER对于基因疗法产品的高度重视。见相关资讯...
|

|
FDA 发布生物制品 CMC 批准后变更定稿指南
2021.06.23
美国 FDA 于 6 月 21 日发布了《已获批生物制品申请的 CMC 变更》定稿指南,帮助生物制品制造商确定其产品哪些类型的变更应在年报中提交,哪些需要提交需事先批准的补充申请(PAS)。
该指南的草案版本于 2017 年 12 月发布,定稿指南对草案做了一些细微的更改。指南涵盖的...
|

|
免费线上讲座(中文翻译):FDA 生物制品研发、合规...
2020.12.16
【识林-Hogan Lovells】FDA 生物制品法规:法律框架与合规优先事项, 2020.12 link=13px
美国 FDA 生物制品法规框架如何?监管要求、批准途径和专营权方面与我们日常所熟悉的小分子药品有何区别?生物制品的制造与合规挑战如何?生物制品场地常见检查观察项的前车之鉴有哪些...
|
|
PDA 细胞产品冻存实践现状调研分析
2020.09.23
第一批成功的冻存研究是在 1949 年开展的1,此后,许多策略被提出并予以采纳,来促进冻存后细胞功能的快速复苏。但可惜的是,尽管经过数十年的研究并在临床上得到了越来越多的重视,但目前仍没有针对细胞和基因治疗药物(先进治疗产品或 ATMP)协调一致的冻存标准,并且在商业和学术团...
|

|
业界再提新证据反对 FDA 生物类似药命名和可互换性...
2020.04.23
业界再次组织新证据呼吁美国 FDA 改变其对生物类似药的命名政策,并重新考虑为证明生物类似药可互换性而进行多次转换研究的需求。
上个月,由 FDA 和联邦贸易委员会(FTC)联合召开的关于生物类似药竞争性市场的研讨会【FDA联手FTC与业界共同商讨如何促进生物类似药竞争 2020/03/...
|

|
蛋白质产品 NDA 向 BLA 过渡的 eCTD 操作说明
2020.03.26
随着 3 月 23 日一些之前作为药品批准的蛋白质产品已经转为生物制品许可【今天起胰岛素等药品将作为生物制品监管】,FDA 于 24 日发布了一份关于 eCTD 过渡的操作说明,详细介绍了在过渡期应怎样使用 eCTD 正确提交对应的申报资料。下面我们具体来看看这份文件:
对于在 2020...
|

|
今天起胰岛素等药品将作为生物制品监管
2020.03.24
从今天起(3月23日),根据美国《联邦食品,药品和化妆品法案》(FD&CA)第505条授权的胰岛素、人类生长激素和其它蛋白质的新药申请(NDA),将被视为“生物制品许可(BLA)”,根据《公共卫生服务法》(PHSA)按照生物制品路径监管。美国 FDA 和相关制药商已经为这一天准备了多年,FD...
|

|
FDA 最新指南明确排除“授权生物类似药”的存在
2020.03.06
距离某些蛋白质产品从作为药品监管过渡到作为生物制品监管仅剩不到三周的时间【视为许可产品从 NDA 到 BLA 过渡的监管变化】,美国 FDA 于 3 月 4 日发布《生物制品价格竞争与创新法案中“视为许可”条款问答》定稿指南,澄清 3 月23 日之后在竞争激烈的胰岛素领域,哪些类型...
|
|
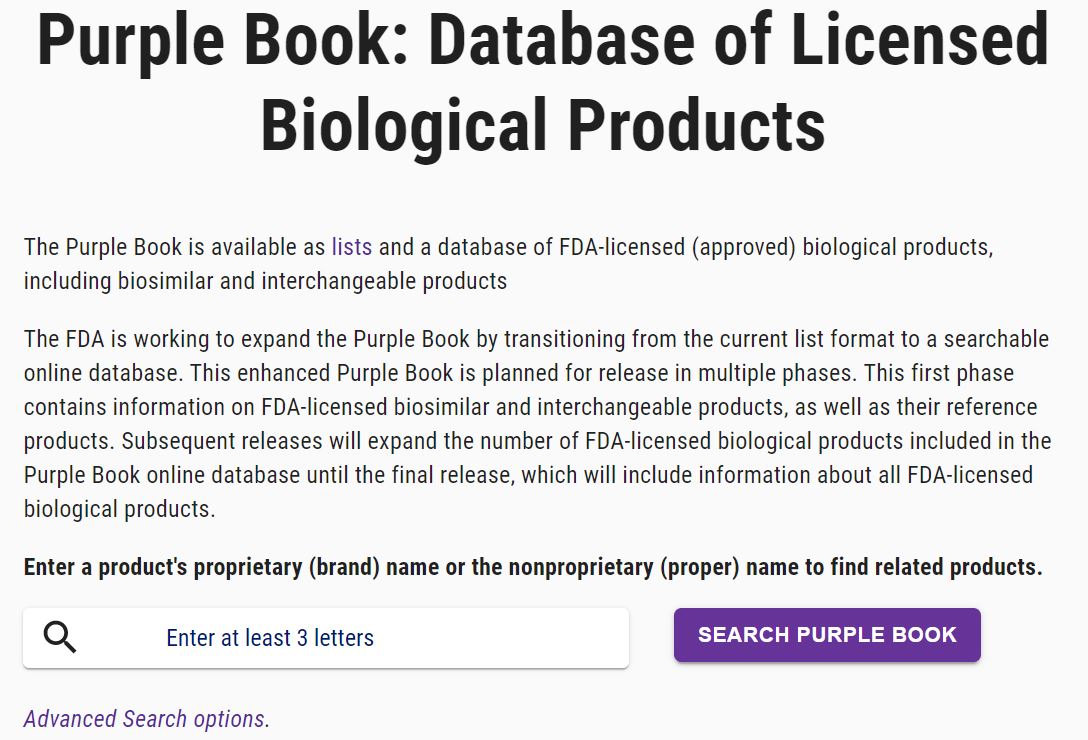
FDA 推出增强版在线紫皮书数据库
2020.02.27
美国 FDA 于 2 月 24 日宣布其推出了第一版可搜索的生物产品信息在线数据库,即在线“紫皮书”。紫皮书于 2014 年首次发布,之前为 PDF 列表形式,现在可以更轻松地对紫皮书进行在线搜索,并包含了有关产品名称(通用名和专利名),所提交的生物制品许可类型,生物制品的规格、...
|
|
FDA 最终确定生物制品定义,依据氨基酸序列大小定义...
2020.02.24
美国 FDA 于 2 月 21 日发布最终规定,修改了“生物制品”的定义,根据氨基酸序列的大小定义蛋白质。下面我们看看 FDA 对于最终“生物制品”定义的解释以及 FDA 对于一些有关定义的反馈意见的回答来进一步了解最终定义背后的监管考量。
根据 2009 年《生物制品价格竞争与创新法...
|

|
FDA致力于确保胰岛素和其他生物制品的监管平稳过渡
2020.02.20
FDA Works to Ensure Smooth Regulatory Transition of Insulin and Other Biological Products
Today, the U.S. Food and Drug Administration took additional steps to ensure a smooth regulatory transition aimed at increasing patient access to insulin prod...
|

|
视为许可产品从 NDA 到 BLA 过渡的监管变化
2020.02.11
根据美国《 2009年生物制剂价格竞争与创新法案》(BPCIA),在美国被批准为新药申请(NDA)的生物产品要过渡到生物制品许可申请(BLA)批准,截止日期即将到来。 自2020年3月23日起,根据《联邦食品,药品和化妆品法》(FDCA)第505条授权的,针对胰岛素,人类生长激素和其它蛋白质的NDA...
|
|
FDA 发布指南草案生物类似胰岛素将不再需要比较性免...
2019.11.27
美国 FDA 于 11 月 25 日发布《生物类似和可互换性胰岛素产品的临床免疫原性考量》指南草案,为美国市场开发生物类似和可互换性胰岛素产品的公司一般情况下将不需要开展比较性临床免疫原性研究。该指南草案预计将受到业界的大力欢迎。
指南指出,“当前用于评估胰岛素产品质量属...
|

|
FDA 将用于分子诊断设备的寨卡病毒参考序列集用于支...
2019.11.25
FDA Zika virus reference panel for molecular-based diagnostic devices supports product testing for Emergency Use Authorization and 510(k) submissions
In response to the urgent need for performance assessment of diagnostic devices that detect https//...
|
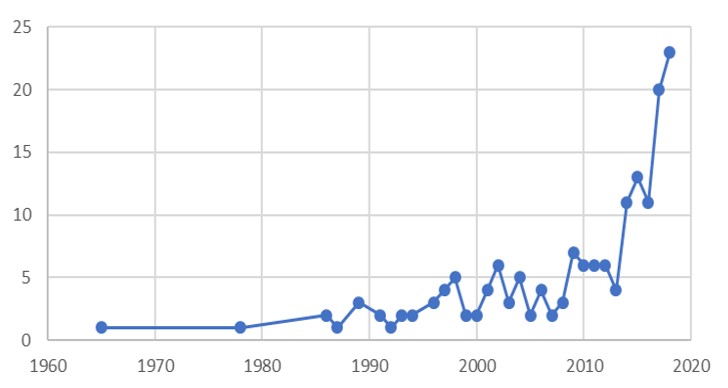
|
从 FDA 批准数据看生物药发展趋势
2019.07.22
2019 年已经过半,我们趁现在来找个机会看看 FDA 和行业在生物药申请批准方面做的如何,同时将这类产品的批准情况放入历史的长河中看看有着怎样的趋势和变化。
从 1965 年到 2013 财年结束,FDA 批准了大约 86 个治疗性生物制品(TBP)。早期,批准率非常缓慢,前 22 年间仅有...
|

|
FDA 将允许按药品获批的生物制品继续参考 DMF
2019.07.02
美国生物制品转换规定将改变最初在新药申请下获批的胰岛素和一些其它蛋白质产品的监管框架。《2009 生物制品价格竞争与创新法案》第 7002(e)(4) 节要求,在 2020 年 3 月 23 日,生物制品的所有新药申请(NDA)将根据《公共卫生服务法案》(PHSA)第 351 条“视为许可(deemed to ...
|