
|
欧盟宣布应对新冠病毒变体的新计划
2021.02.19
欧盟于 2 月 17 日宣布了一项应对新冠(COVID-19)病毒变体的计划:将建立一个新的称为“HERA 孵化器“的生物防御准备计划,与欧盟和全球研究者、生物技术公司、制药商和公共机构合作,检测和评估新变体,为开发新型和调整疫苗提供激励措施,加快这些疫苗的批准程序,并确保扩大生产能...
|
|
FDA 将制定新指南并召开疫苗专家会应对新冠病毒变种
2021.02.06
新冠(COVID-19)病毒变种促使新冠疫苗生产商开始开发现有产品的更新。为加快这一开发过程,美国 FDA 表示正在制定有关针对变种病毒的更新疫苗的加快审评规则。
FDA 在决定是否因 SARS-CoV-2 病毒的新变种而要求新冠治疗药或疫苗更新紧急使用授权(EUA)时将考虑多个因素,包括...
|

|
英国兴建疫苗制造与创新中心开发新制造工艺
2021.02.05
英国面向未来的疫苗采购吸引了来自英国政府的巨额投资,以及制药行业的资金承诺和学术界的科学专业知识的投入。在英国牛津郡的一个大型中心 — 疫苗制造与创新中心(VMIC)很快将在中央基金的资助下开始运转。
VMIC 的建立是为了促进和加速英国疫苗行业的发展。这是英国第一个专门的...
|
|
FDA 对于新冠疫苗儿科保护效力桥接研究方面的建议
2021.02.01
美国 FDA 官员表示,识别保护性免疫相关性将使新冠(COVID-19)疫苗更容易扩展到儿科人群中,但是,缺乏此类相关性并不一定是从成人保护效力数据桥接到儿科人群的障碍。
FDA 疫苗研究与审评部门临床审评副主任 Doran Fink 在 1 月 27 日疾病控制与预防中心(CDC)的免疫咨询委员...
|
|
FDA 希望识别新冠疫苗保护的免疫相关性,专家提醒可...
2021.01.13
美国 FDA 和美国国立卫生研究院(NIH)与制药公司合作,将在接下的几周到几个月内密切合作,以确定有关新冠(COVID-19)疫苗保护的免疫相关性数据,例如抗体水平或与疫苗预防相关的非特异性免疫。
FDA 局长 Stephen Hahn 在 1 月 8 日的卫生政策联盟媒体简报中表示,“一旦...
|

|
【周末杂谈】新冠疫苗与消除性免疫(sterilizing immu...
2021.01.10
种了新冠疫苗,健康码就应该变绿,就可以出行自由了吗?
种了新冠疫苗的人,就不会被他人感染而得新冠了。但种了疫苗的人是否仍会传染他人呢?也就是说新冠疫苗是只管种了疫苗的人而不管他人的“自私”疫苗吗?若是仍会传染,那健康码就仍不能变绿,出行时还需要做核酸或抗体检验,那疫...
|

|
科学家批评印度在缺乏有效性数据的情况下匆忙批准新冠...
2021.01.08
《科学》(Science)杂志网站近日发文指出,印度药品监管机构在没有等待确定的有效性和安全性 III 期试验结果的情况下,于 1 月 3 日授权了印度 Bharat Biotech 公司开发的新冠(COVID-19)疫苗 Covaxin,这一行动引发了一些科学家和患者倡导组织的严厉批评。
在周日的新闻...
|

|
辉瑞计划加快向试验安慰剂组受试者提供新冠疫苗接种
2021.01.06
辉瑞及其合作伙伴 BioNTech 计划在 3 月 1 日之前为临床试验中接受安慰剂的志愿者提供新冠(COVID-19)疫苗,这比起最初计划的时间提早了几个月时间。
这项决定代表了美国FDA、辉瑞和疫苗志愿者以及开发另一 mRNA 疫苗的 Moderna 公司之间复杂的公开博弈。FDA 及其专家顾问...
|
|
辉瑞新冠疫苗首获 WHO 紧急使用,英国和印度先后授...
2021.01.02
世界卫生组织(WHO)于 12 月 31 日宣布将 COMIRNATY® COVID-19 mRNA 疫苗列入紧急使用清单(Emergency Use Listing,EUL),这使得辉瑞/BioNTech 的疫苗成为自新冠(COVID-19)爆发一年以来首个获得 WHO 紧急认证的疫苗。
WHO EUL 为各国加快进口和管理疫苗的监管审批...
|

|
英国和印度或于下周批准阿斯利康新冠疫苗
2020.12.24
印度很可能在下周批准牛津/阿斯利康的新冠(COVID-19)疫苗用于紧急使用,可能成为第一个为阿斯利康疫苗提供监管许可的国家。而英国紧急情况科学顾问小组成员本周三也表示英国政府可能会在圣诞节之后授权阿斯利康疫苗。
据路透社报道,印度作为世界上最大的疫苗生产国,希望在下个月...
|

|
欧盟附条件批准辉瑞-BioNTech 新冠疫苗
2020.12.22
欧洲药品管理局(EMA)于 12 月 21 日周一建议欧盟委员会对辉瑞/BioNTech 的新冠(COVID-19)疫苗授予附条件上市许可,几个小时后欧盟委员会对疫苗签发了正式附条件上市许可(CMA)。欧盟范围内的首次疫苗接种预计将在本周末(12 月 27 日)开始。
EMA 对 COVID-19 疫苗...
|

|
印度新冠疫苗试验不良反应引发质疑,辉瑞疫苗需要在印...
2020.12.22
印度药品管理总局(DCGI)可能会要求辉瑞/BioNTech 寻求在印度的加速批准(类似于紧急使用授权)之前进行本地临床试验。
这可能是辉瑞/BioNTech 在全球批准道路上遇到的第一个关卡。在 12 月 9 日 DCGI 的专家委员会上,辉瑞印度公司曾希望有更多时间做介绍。在那之后,辉瑞...
|

|
新冠疫苗领跑者已撞线,后来者面临更多试验执行困难
2020.12.19
随着几款新冠(COVID-19)疫苗陆续在多个国家获得紧急使用授权或暂时使用,目前仍然在试验中的疫苗可能面临这更多问题,包括揭盲策略、参与者脱落、两种不同疫苗之间的相互作用等等。
在 FDA 上周批准首个 COVID-19 疫苗之时,阿斯利康向在美执行临床试验的研究者发出了文件,说...
|
|
FDA 关于 Moderna 新冠疫苗紧急使用授权的专家会资...
2020.12.18
美国 FDA 于 12 月 17 日召开疫苗与相关生物制品专家委员会(Advisory Committee)会议讨论 Moderna 的新冠(COVID-19)疫苗 mRNA-1273 的有效性和安全性是否足以支持紧急使用授权(EUA)。会议表决结果为:20 赞成,0 反对,1 弃权。有关会议讨论的详细报道请见【快讯】Mode...
|
|
【快讯】Moderna 新冠疫苗专家会意见,20-0 支持紧...
2020.12.18
北京时间 12 月 18 日早 6 点 10 分,美国 FDA 就 Moderna 新冠(COVID-19)疫苗 mRNA-1273 的紧急使用授权(EUA)召开的专家会刚刚结束。在结束了一整天 8 个多小时对 Moderna 新冠疫苗的广泛讨论后,外部专家以 20 赞成,0 反对,1 弃权,认为基于可用全部科学证据,Moder...
|
|
欧盟新冠疫苗专家投票日期提前,使用附条件批准路径
2020.12.17
欧洲药品管理局(EMA)迫于政治压力预期将在下周就首个新冠(COVID-19)疫苗给出附条件上市批准建议。
EMA 之前计划“最迟”在 12 月 29 日之前就辉瑞/BioNTech 的 COVID-19 疫苗 BNT162b2 做出决定,但现在将这一决定提前至 12 月 21 日。EMA 专家的预期投票结果将...
|
|
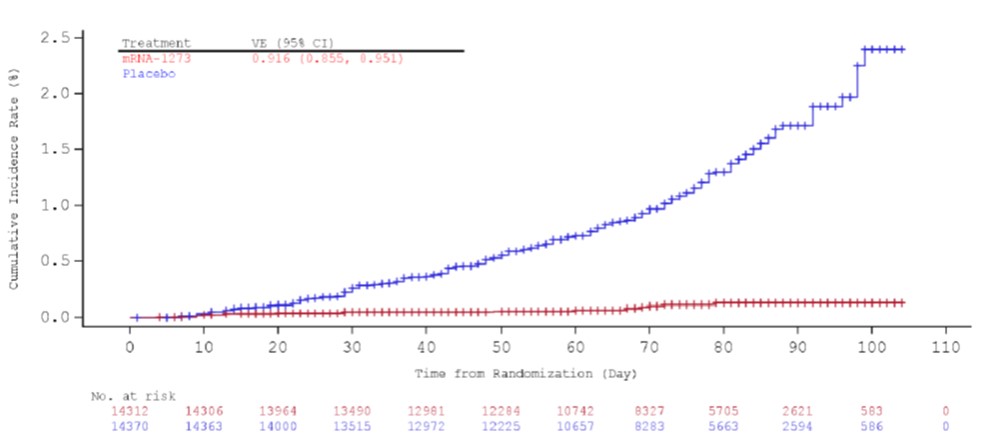
Moderna 新冠疫苗专家会会前资料,非常有效但不良反...
2020.12.16
美国 FDA 于周二(12月15日)发布了针对 Moderna 新冠(COVID-19)疫苗紧急使用授权(EUA)的专家咨询委员会(advisory committee)的部分会前资料,FDA 审评科学家认为该疫苗安全有效。
在计划于本周四召开的疫苗和相关生物制品咨询委员会会议上,外部专家将投票表决 Moderna COVI...
|

|
EMA 新冠疫苗数据被黑客攻击,冷链组织或也受到网络...
2020.12.11
欧洲药品管理局(EMA)于 12 月 9 日在其网站上发布了一条简短的通知,透露 EMA 遭到网络攻击,但没有关于攻击程度的任何细节。但德国疫苗开发商 BioNTech 发表声明表示,其与辉瑞公司合作开发的新冠(COVID-19)疫苗 BNT162b2 有关的提交到监管机构的文件存储在 EMA 服务器...
|
|
【快讯】辉瑞新冠疫苗专家会意见,17-4 赞成紧急使...
2020.12.11
截至发稿前 20 分钟(北京时间 12 月 11 日早上 6:40),美国 FDA 关于辉瑞-BioNTech 的新冠(COVID-19)mRNA 疫苗 BNT162b2 召开的专家会刚刚结束。
经过 8 个多小时的数据演示、问答、讨论和辩论,外部专家们就“基于现有的全部科学证据,辉瑞-BioNTech COVID-19...
|
|
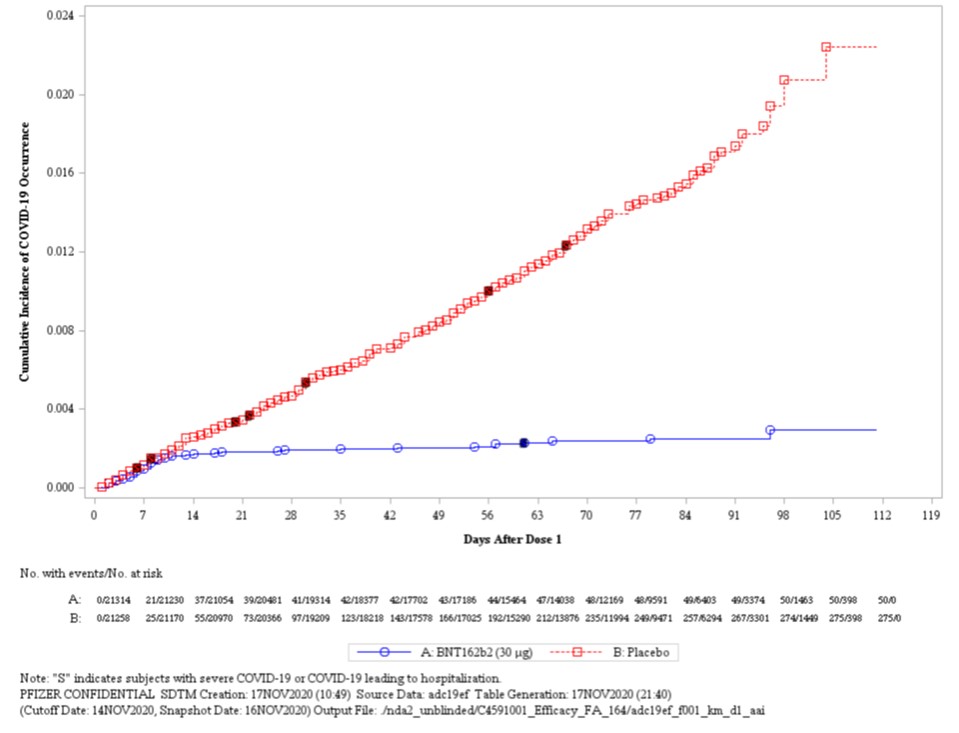
FDA 疫苗专家会会前资料公布,认为辉瑞新冠疫苗非常...
2020.12.09
美国 FDA 在周二(12 月 8 日)发布的疫苗专家咨询委员会(advisory Committee)会前资料中认可了辉瑞和 BioNTech 的新冠(COVID-19)疫苗 BNT162b2 的有效性和安全性。
这些文件是即将在本周四举行的疫苗外部专家会议的背景材料,此次专家会颇受关注,被视为是 FDA 颁发首个 C...
|