
|
今天起胰岛素等药品将作为生物制品监管
2020.03.24
从今天起(3月23日),根据美国《联邦食品,药品和化妆品法案》(FD&CA)第505条授权的胰岛素、人类生长激素和其它蛋白质的新药申请(NDA),将被视为“生物制品许可(BLA)”,根据《公共卫生服务法》(PHSA)按照生物制品路径监管。美国 FDA 和相关制药商已经为这一天准备了多年,FD...
|
|
远程分散式临床试验的考量要点
2020.03.20
昨日我们介绍了 FDA 发布的关于在新冠疫情(COVID-19)期间开展临床试验的最新指南【FDA 对于疫情期间临床试验的执行提供建议】,今天我们来看看更具灵活性的远程分散式临床试验在这一特殊时期以及今后能够申办人带来怎样的可能性,以及如果开展此类试验需要注意些什么。
随着人们...
|

|
FDA 对于疫情期间临床试验的执行提供建议
2020.03.19
美国 FDA 于 3 月 18 日新发布了《关于新型冠状病毒疾病(COVID-19)大流行期间医药产品临床试验的执行》定稿指南,帮助申办人确保试验参与者的安全,保持临床试验质量管理规范(GCP)的合规性并最大限度地降低 COVID-19 大流行期间试验完整性(integrity)风险。
美国国家卫...
|

|
FDA 竞争性仿制药指南定稿版本与草案有哪些不同?
2020.03.17
美国 FDA 于 3 月 13 日发布《竞争性仿制药》定稿指南,介绍了 FDA 竞争性仿制药(CGT)认定的内容、何时适用以及如何应用等关键要素。CGT 认定是根据 2017 年《FDA 重新授权法案》(FDARA)建立的,旨在激励缺乏竞争的仿制药的开发。FDA 局长 Stephen Hahn 表示,“CGT ...
|

|
英国 MHRA 关注新冠疫情引发的临床试验相关偏差上升
2020.03.14
英国药品与医疗保健产品监管机构(MHRA)表示,由于新型冠状病毒肺炎(COVID-19)疫情爆发,预计正在开展的临床试验中与试验方案相关的偏差将会增加。世界卫生组织(WHO)于 3 月 11 日宣布 COVID-19 疫情为全球大流行(pandemic)。【WHO 宣布全球大流行,FDA 暂停境外检查和外部会议...
|

|
FDA联手FTC与业界共同商讨如何促进生物类似药竞争
2020.03.13
美国 FDA 和联邦贸易委员会(FTC)于 3 月 9 日举行的生物类似药竞争性市场研讨会吸引了大批与会者参加。会议主要提供了当前生物类似药市场的概况,并给出之前曾再三提出的如何消除生物类似药使用障碍的建议。研讨会大约有 85 人现场参会,另有 300 人通过网络参会。
这是一...
|

|
FDA 发布替代电子格式提交指南,宣布支持新数据标准
2020.03.13
美国 FDA 于3 月 10 日发布《以替代电子格式提交监管申报》的指南草案,详细介绍了有资格获得电子通用技术文档(eCTD)豁免的申报资料的替代电子格式。
上个月 FDA 定稿了《以电子形式申报 — 采用eCTD规范的某些人用药品申请及相关申报资料》,定稿版本是这一指南文件的第七...
|
|
FDA 发布评估 2 型糖尿病治疗药安全性的新指南,不...
2020.03.11
美国 FDA 于 3 月 9 日发布《2 型糖尿病:评估新药的安全性以改善血糖控制》指南草案,倾向于对目标人群的心血管风险评估进行更长期且更广泛的安全性评估。
新指南草案取代了 FDA 2008 年关于评估 2 型糖尿病药物心血管风险的指南以及 2008 年发布的关于开发治疗或预防糖...
|

|
FDA 新发布指南鼓励将老年患者纳入癌症临床试验
2020.03.11
美国 FDA 于 3 月 5 日发布指南草案《在癌症临床试验中纳入老年患者》,希望鼓励制药商在癌症临床试验中纳入更多老年患者,以确保这些研究中的患者人群能够更好地反映真实世界中的患者人群。
FDA 肿瘤卓越中心主任 Richard Pazdur 表示,“在临床试验中招募广泛的患者代表是...
|
|
诺华前雇员起诉称因揭露数据错误而被解雇
2020.03.10
诺华公司一名前雇员称她因指出诺华关于眼用药 Beovu 的不正确安全性数据而被开除。
Zuhal Butuner 在去年 2 月份提起的诉讼中描述了她曾在 2018 年 3 月建议诺华就有关 Beovu(brolucizumab)的已发布安全性数据中的“重大错误”发布新闻稿或向医生发信,Beovu 当时是正在...
|

|
最新研究估算药物开发成本约为 13 亿美元,引发各方...
2020.03.10
关于新药开发的成本估算一直以来被用作在药品投放市场后定价辩论中的武器。制药业通常引用 2016 年 Tufts 大学药物开发研究中心的成本研究数据 28 亿美元1,认为价格必须足够高才能弥补巨大的财务风险。但是有批评人士有时会引用低至 4300 万美元的数字,认为较高的药物研发成本只...
|

|
FDA 最新指南明确排除“授权生物类似药”的存在
2020.03.06
距离某些蛋白质产品从作为药品监管过渡到作为生物制品监管仅剩不到三周的时间【视为许可产品从 NDA 到 BLA 过渡的监管变化】,美国 FDA 于 3 月 4 日发布《生物制品价格竞争与创新法案中“视为许可”条款问答》定稿指南,澄清 3 月23 日之后在竞争激烈的胰岛素领域,哪些类型...
|

|
FDA 指南快读(Guidance Snapshots)试点计划一瞥
2020.03.05
美国 FDA 于 2 月 28 日宣布了一项新的试点项目:为一系列与现代化药物临床试验和加速药物开发相关主题的跨领域指南文件发布“指南快读”。
到目前为止 FDA 已经针对其中的三份指南发布了快读,这些快读使用了形象简洁的语言,提供了指南中的重点内容。其中两份快读与通过临床...
|
|
胰岛素巨头反对 FDA 豁免生物类似药临床免疫原性
2020.03.03
美国三大胰岛素制药商中的两家正在力图改变 FDA 指南草案,以阻止更多胰岛素竞争进入市场。
该指南草案于去年 11 月发布,题为《生物类似和可互换性胰岛素产品的临床免疫原性考量》,主要解释了胰岛素生物类似药开发商在什么情况下可以无需开展比对临床免疫原性研究。作为 FDA 关...
|
|
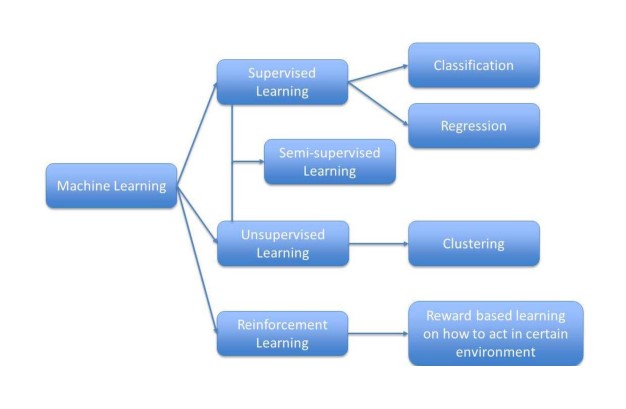
FDA 预测机器学习将在药物研发和审评中发挥更加重要...
2020.03.03
机器学习(machine learning,ML),第一个正式的定义来自卡内基梅隆大学的Tom Mitchell教授,他认为一个计算机程序在完成一项具体任务时,其性能可随着经验的积累而不断自我完善,那么这个程序是在从经验中学习。在过去十年中,由于互联网的发展带动了大量数据的生成, ML几乎为我们...
|

|
美国拟建连续制造卓越中心帮助仿制药商采纳新技术
2020.03.02
罗格斯(Rutgers)大学教授 Fernando Muzzio 在国会听证会上作证时表示,虽然品牌药公司正在应用连续制造,但其他公司(包括仿制药和非处方药公司)却在为实施连续制造所需的成本和知识而苦苦挣扎。
1 月 29 日,Muzzio 在众议院能源与商贸委员会卫生分委会举行的关于一系列涉及...
|

|
ICH 发布生殖毒性和发育毒性检测指南
2020.02.28
ICH 于 2 月 18 日发布 S5(R3)《人用药物生殖毒性和发育毒性的检测》定稿指南,在这份 127 页的指南中,ICH 为评估用于支持临床试验和药物批准的非临床发育和生殖毒性检测的协调方法提出了建议。该指南是 ICH 自 1993 年引入 S5指南以来的第三次修订。
ICH 表示,该指...
|
|
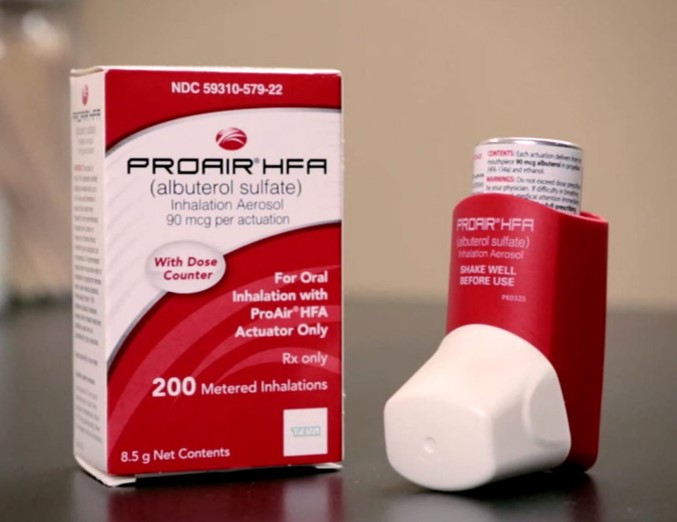
FDA 批准首个仿制硫酸沙丁胺醇吸入剂,国会关注复杂...
2020.02.26
美国 FDA 于 2 月 24 日批准了首个仿制 ProAir HFA(硫酸沙丁胺醇)吸入气雾剂,用于治疗或预防四岁及以上患有可逆性阻塞性气道疾病患者的支气管痉挛,并预防四岁及以上患者运动性支气管痉挛。
FDA 局长 Stephen Hahn 表示,“这是在美国最常用的急救吸入器的首个获批仿制...
|

|
FDA 发布基因药物相互作用清单,加强对遗传学检测的...
2020.02.25
2 月 20日,美国 FDA 发布药物遗传学相关性表格,尝试一种不同的方式来对药物遗传学检测信息进行分类,以使处方医生和患者收到 FDA 提供的有用信息,远离未经证实的基因-药物相互作用。FDA 的这一努力凸显了其在针对实验室开发的检测没有明确监管框架的情况下所面临的挑战。
FD...
|
|
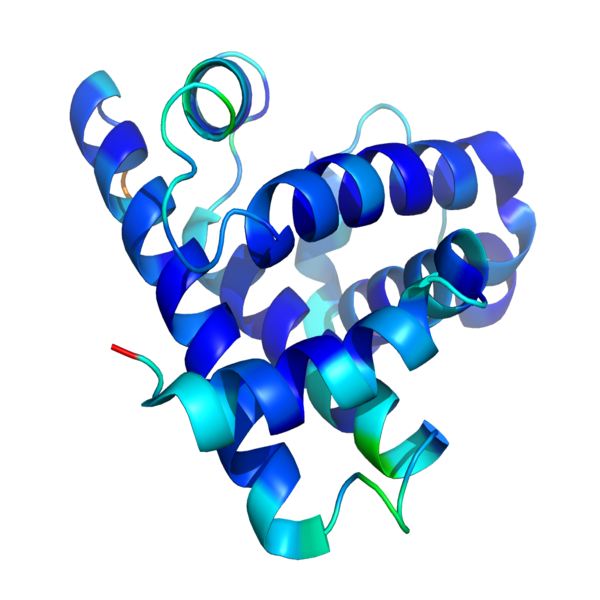
FDA 最终确定生物制品定义,依据氨基酸序列大小定义...
2020.02.24
美国 FDA 于 2 月 21 日发布最终规定,修改了“生物制品”的定义,根据氨基酸序列的大小定义蛋白质。下面我们看看 FDA 对于最终“生物制品”定义的解释以及 FDA 对于一些有关定义的反馈意见的回答来进一步了解最终定义背后的监管考量。
根据 2009 年《生物制品价格竞争与创新法...
|