
|
FDA 药品中心主任谈在云端建立全球质量档案
2020.01.18
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 指出,解决日益严重的国际药品制造质量要求冲突问题的唯一途径是建立全球质量档案。
她在 12 月份的 PDA 质量风险管理会议上分享了关于这一愿景的一些想法,如果实现这些想法,不仅可以简化新药的生产,而且可以持续...
|

|
FDA利用技术和合作来支持罕见病药品研发
2020.01.17
FDA Harnesses Technology and Collaboration to Support Rare Disease Product Development
Announcing an Orphan Drug Technology Modernization effort and the 2020 FDA Rare Disease Day meeting
By Amy Abernethy, M.D., Ph.D., Principal Deputy Commissione...
|
|
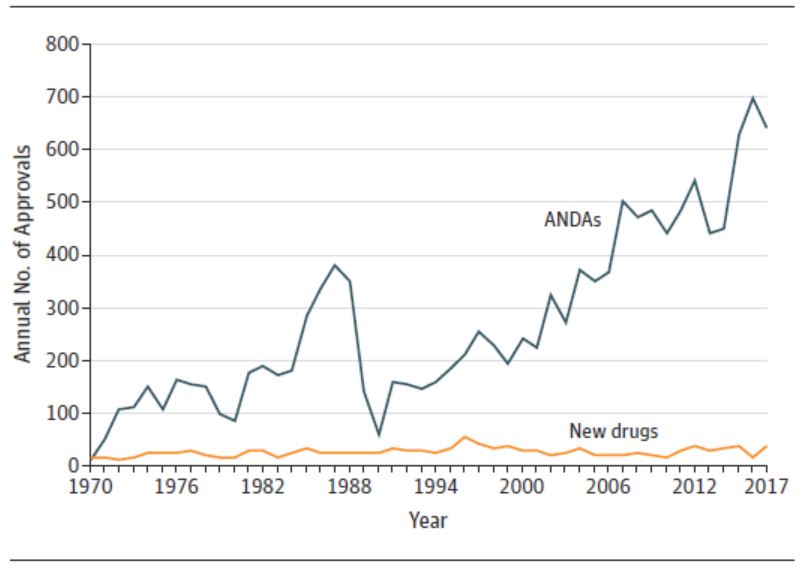
过去四十年 FDA 新药审批改革成效如何,需再次改革...
2020.01.16
1 月 14 日发表在 JAMA 上的一篇题为“1983-2018 FDA 药品批准和监管”的通讯文章引发了业界的广泛关注,文章认为美国 FDA 在过去四十年中进行的加快审评的改革可能需要进一步做出改变。文章作者为哈佛医学院布莱根妇女医院医学系的 Jonathan Darrow 等人。
总体而言,文章...
|

|
FDA 新十年的大麻政策
2020.01.15
Cannabis Policies For the New Decade
Testimony of
Douglas Throckmorton, M.D.
Deputy Director for Regulatory Programs - Center for Drug Evaluation and Research CDER
Before the
https//energycommerce.house.gov/subcommittees/health-116th-congress...
|

|
【全文翻译】2019 年 FDA 新药审批总结报告
2020.01.11
美国 FDA 于 2020年 1 月 6 日发布了 2019 年度新药审批总结报告,报告汇总了 FDA 药品审评与研究中心(CDER)去年批准的所有新药、新用途和新适用人群,以及生物类似药、新配方和新剂型药物,概述了一系列值得注意的批准,提供了许多 CDER 批准的新治疗药物促进患者健康的有...
|

|
创新药 MAH 早期临床阶段需要什么程度的质量体系?
2020.01.10
MAH推进和创新药热潮,催生生产和检验完全外包的虚体药企。那么问题来了,这些企业在早期临床,具体来说就是临床I期,需要什么程度的质量体系呢?具体而言,需要多少个SOP呢?尤其是全生命周期GMP管理理念的盛行,可能产生两极分化,造成资源浪费和效率低下,甚至本末倒置 – 临床I期的...
|

|
2019年 FDA新药审批总结
2020.01.06
Innovation in New Drug Approvals of 2019 Advances Patient Care Across a Broad Range of Diseases
In 2019, the FDA approved a wide variety of new drug therapies to help patients in need.
2019年创新型新药批准推动了一系列疾病的患者...
|

|
FDA 发布指南讨论组合产品申办人与 FDA 沟通的最佳...
2020.01.04
美国 FDA 于 12 月 23 日发布《请求 FDA 对组合产品反馈》的指南草案,讨论了组合产品申办人如何从 FDA 获得有关科学和监管问题的反馈,并介绍了当 FDA 与申办人进行互动时的最佳实践。指南指出,这些互动可以通过基于申请的会议机制(通常是最有效的沟通方法),或者通过组合产品...
|

|
药业的 2010 年代:加速、创新和充满争议的十年
2020.01.03
回顾二十一世纪的第一个十年,我们应如何评判这十年间的制药业?十年的时间跨度不可避免的充斥着成功与失败、飞跃与绝境、协调与冲突,下面我们看看总部在伦敦的全球大型出版商 Informa 的撰稿人 Andrew McConaghie 对这十年制药行业的总结分析。
癌症、丙型肝炎、罕见疾病方面的...
|
|
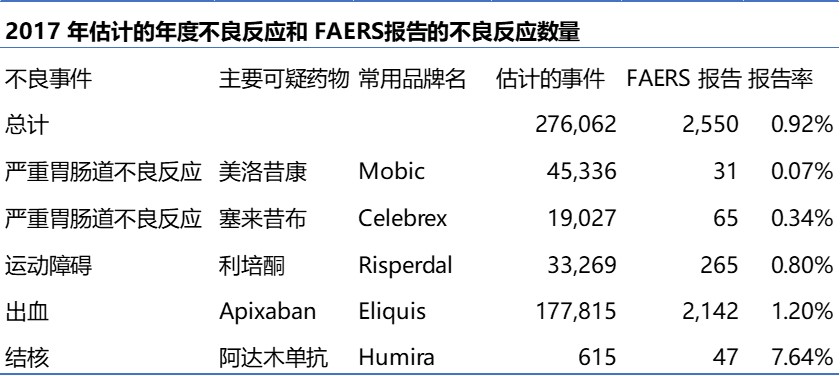
漏报到 FDA 的药物副作用数量可能被严重低估
2020.01.03
众所周知,很多药物副作用并没有报告到药监局,但具体漏报程度如何,一份新的报告表明问题远超想象。这一问题在非营利组织安全药物实践研究所(Institute for Safe Medicines Practices,ISMP)发布的 QuarterWatch Report 中提出。
报告审查了有关五种广泛使用的药物(两种不同...
|

|
全球政策和战略办公室—欧洲办公室
2020.01.02
Europe Office
Established in May 2009, the Europe Office serves as the lead for the FDA’s on- site presence in Europe. It covers the European Union and individual countries that are not EU members, such as Switzerland and Norway and facilitate...
|

|
2020 年数字医疗公司需要考虑的三大问题
2019.12.31
从数字上看,2019 年又是数字医疗公司的一个大年。随着公司大量敛钱投资开发新型可穿戴设备、个性化数字服务和机器学习工具以改善疾病的治疗,该领域的总投资预计将达到创纪录的 84 亿美元。几家公司也已进入公开市场,苹果、亚马逊、谷歌和微软等科技巨头加大了对医疗方面的投资,并招...
|

|
吸入器与吸入制剂的当前挑战与开发趋势
2019.12.30
从历史上看,吸入药物递送仅限于呼吸系统疾病的治疗和管理,例如哮喘或慢性阻塞性肺病。然而,这种递送方法已经扩展为许多系统疾病的替代治疗方案,包括内分泌和神经系统疾病,这些疾病可以受益于吸入性递药方案提供的频繁脉冲式给药。
与口服或注射给药相比,吸入性替代方案更好地模拟...
|

|
US-EU 互认协议药品附录的影响力测量
2019.12.30
Measuring the Impact of the Pharmaceutical Annex to the U.S./EU Mutual Recognition Agreement
December 6, 2019
By Mark Abdoo
When we first began discussing the prospects of a mutual recognition agreement with the European Union, in which EU mem...
|

|
器械还是药品?法院限制了 FDA 的自由裁量权
2019.12.27
药品和器械之间的一个关键区别是:药品和器械药遵守不同的监管框架,并且药品的监管繁琐而昂贵。一款仿制药首年的使用者费总计为 30 万美元,而器械仅为 7600 美元左右,而根据 505(b) 途径批准的药品的使用者费更高,2019 财年总计约 250 万美元。另外,药品还需遵守更严格的...
|

|
欧洲药品管理局着手机构改革,应对新挑战
2019.12.24
欧洲药品管理局(EMA)将着手开展涉及机构改革的“面向未来”的行动,以使其能够更有效地应对“人员的永久减少”以及在科学、技术和立法方面的新挑战。
EMA 管理委员会 12 月会议上提出的新架构包括成立四个新的工作组,以聚集在“高影响力领域”的专家,例如数字化转型、监管科学与...
|

|
FDA 就证明药品有效性所需的实质性证据提供更多灵活...
2019.12.23
美国 FDA 于 12 月 19 日发布《证明人用药和生物制品有效性的实质性证据》指南草案,旨在为计划提交新药申请(NDA)、生物制品许可申请(BLA)或补充适应症申请的申请人提供证明有效性所需实质性证据(substantial evidence)方面的指导。
背景
该指南补充并扩展了 1998 年...
|

|
美国科学院就急性疼痛阿片类药物处方指南的制定提供建...
2019.12.23
美国国家科学、工程和医学研究院(NASEM)于 12 月 19 日发布《制定用于急性疼痛的阿片类药物处方指南》共识研究报告,确定了需要在哪些领域开展更多研究以制定可靠的循证临床实践指南(clinical practice lines, CPGs)。
美国 FDA 应对持续的阿片类药物危机的目标之一是通...
|

|
FDA批准Eliquis的首仿药
2019.12.23
FDA approves first generics of Eliquis
For Immediate Release December 23, 2019
The U.S. Food and Drug Administration has approved two applications for the first generics of Eliquis (apixaban) tablets to reduce the risk of stroke and systemic embol...
|
|
FDA批准治疗成人偏头痛的新疗法
2019.12.23
FDA approves new treatment for adults with migraine
For Immediate Release December 23, 2019
The U.S. Food and Drug Administration today approved Ubrelvy (ubrogepant) tablets for the acute (immediate) treatment of migraine with or without aura (a s...
|