
|
仿制药办公室正在出台更多指南
2014.02.25
仿制药办公室正在出台更多指南
今天,在佛罗里达州奥兰多举行的仿制药生产商协会年会上进行的科学与监管咨询委员会会议上,仿制药办公室(OGD)规制顾问Keith Flanagan展望了一些产业界有望在短期内见到的指导性文件。
这些即将出台的新文件旨在阐明GDUFA的工作方式,包括申请提...
|

|
FDA着手改革非处方药审批路径
2014.02.25
FDA着手改革非处方药审批路径
— 计划于三月份召开听证会征询公众意见
2014年2月22日
THOMAS M. BURTON
美国食品药品管理局计划调整其非处方药审批方式,此举将给数以万计的药品与个人护理用品进入美国市场带来改变。
这些产品—无论是止痛药、防晒剂还是抗真菌药...
|

|
FDA支持药品研发中采取灵活手段的理由
2014.02.24
大家都知道人各有异,同样每种疾病每种药品也是不同的。
所以我们对于《美国医学会杂志》(JAMA)公布的一项最新研究结果并不惊讶。这项研究显示,在2005年到2012年期间,在审批用于208种适应症的188种新治疗药品时,FDA使用一系列不同的临床试验证据。这一结果与我们近期的监管指令完...
|

|
业界如何做可使其申请质量更高?FDA希望知道!但是,...
2014.02.23
我昨日收到了FDA问计如何提高仿制药申请质量的邮件(我相信你们之中许多人也收到了)。FDA已设立了案卷收集公众反馈,同时希望了解将这些建议分享给业界的最佳途径。邮件正文抄录如下:
FDA希望听到您的建议!我们已设立https//www.federalregister.gov/articles/2014/01/23/2014-01309...
|

|
近期临床研究显示一降糖药涉及心血管风险
2014.02.20
《新英格兰医学学报》发表的一项研究显示,与对照治疗方案相比,使用沙格列汀(saxagliptin)致使心脏泵血不足,或可导致患者心脏衰竭住院的比率升高。美国食品药品管理局(FDA)已将相关安全信息放入其网站,并要求生产商提供更多数据。
沙格列汀(商品名为Onglyza和Kombiglyze XR)于...
|

|
FDA的标签修改拟议规定仅影响标签印刷开销?
2014.02.15
如果你认为FDA的标签修改拟议规定仅影响印刷标签的开销——请三思!
智囊机构美国企业研究所(AEI)的Alex BrillBrill也不这样认为,并在为美国仿制药生产商协会(GPhA)开展的一项经济学分析中表达了自己的观点。该项研究概括了FDA在评价中显然忽视相关下游成本的下列领域:
仿...
|

|
GPhA激烈批评FDA的仿制药标签提议不切实际
2014.02.15
分析点评 — 中文翻译
在反对FDA允许仿制药生产商以CBE-0变更形式作出标签安全性更新的拟议规定的游说的进一步更新中,作为主要的仿制药行业协会,仿制生产商药协会(GPhA)于2014年1月29日发布一份白皮书,也对该拟议规定表示“严重关切”。
在白皮书摘要中,仿制药协会称:
...
|

|
阿斯利康Brilinta的研究遭遇挑战—临床研究中心脏病发...
2014.02.11
阿斯利康Brilinta的研究遭遇挑战—临床研究中心脏病发作统计受到质疑
2014年2月2日下午744
2011年6月,FDA批准了阿斯利康公司的抗凝血药Brilinta用于冠状动脉病情严重患者。一项研究已证明该药可并挽救生命并降低心脏病发作这的确是让人感到眼前一亮的药品。
但在幕后,有关...
|

|
FDA仿制药安全性标签变更法律先占性问题引发关注
2014.02.03
各位可能注意到了FDA于2013年11月发布了拟议规定,允许仿制药生产商变更产品商标以反映新的安全性信息【仿制药公司雪上加霜,需上报不良反应 识林资讯】。该拟议机制与以往NDA持有人使用的待批变更(CBE-0)补充申请提交相同。自Hatch-Waxman法案生效以来,NDA持有人就不断在做与安全性...
|
|
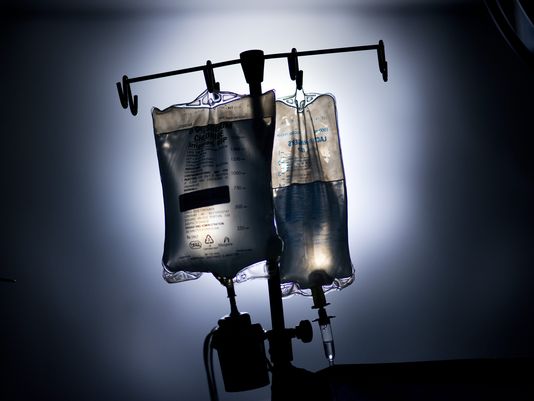
美国医院出现静脉注射用生理盐水短缺
2014.01.31
美国医院出现静脉注射用生理盐水短缺
Susan Kelly2014年1月28日
美国食品药品管理局周二称,正与三家静脉注射用生理盐水生厂商协商,共同解决医院病患补水需求高峰而导致的生理盐水短缺的问题。
“医疗机构正在为病情最严重的患者储备生理盐水,作为应对,三大生产商-百特国...
|

|
罕见之事:FDA向行业问计,如何提高ANDA质量!
2014.01.31
罕见之事:FDA向行业问计,如何提高简化新药申请(ANDAs) 质量!
1月23日,FDA在联邦公报(Federal Register)上发表了一篇题为“提高递交FDA的简化新药申请的质量—建立公共卷宗(Public Docket)”的公告。
其目的如下述:
“FDA将建立公共卷宗,接收公众对于提高提交给FDA...
|

|
虚拟企业请注意—《FDA安全和创新法案》调高热度
2014.01.29
虚拟企业请注意—《FDA安全和创新法案》调高热度
2012年,《FDA安全和创新法案》(Food and Drug Administration Safety and Innovation Act, FDASIA)在食品药品与化妆品法案501(a)(2)(B) 一节中增加了如下表述,扩展了现行药品生产质量管理规范 (current good manufacturing...
|

|
仿制药办公室征询关于如何改善简化新药申请的意见
2014.01.28
仿制药办公室征询关于如何改善简化新药申请的意见
在2014年1月23日公布的联邦公告中,仿制药办公室征询关于如何改善递交的简化新药申请(ANDA)质量以及此类申请相关修订的意见与建议。此外,仿制药办公室也在询问企业在准备简化新药申请中所遇到的具体困难,以便FDA可能 为业界“提供...
|

|
FDA拒绝用于多发性硬化症的开创性药品
2014.01.27
FDA拒绝用于多发性硬化症的开创性药品
— 30个发达国家批准了Lemtrada,而美国拒绝批准,彰显监管改革的必要
作者:CHRISTOPHER DEMUTH SR. And CHRISTOPHER DEMUTH JR.
2014年1月16日
阿仑单抗目前用于静脉给药治疗一种白血病。但一项历时20年、以剑桥大学...
|

|
CMC中“原料药与制剂的杂质列举、表征及其限度依据的...
2014.01.14
FDA仿制药办公室(OGD, Office of Generic Drugs)悄无声息地在其“业界信息”页面列上了一套新表格。这些表格题为“原料药与制剂的杂质列举、表征及其限度依据的汇总表”,显然是必须完成并在新ANDA中与其他CMC数据一同提交。这些表格并没有注明日期,但提及表格需要完成并提交的段...
|

|
FDA仿制药办公室的“甜甜圈空洞”
2014.01.11
爆炸性消息!12月份简化新药申请ANDA数目激增,GDUFA的目标函可能暴露出仿制药办公室(OGD)的甜甜圈空洞
几天前,我写了一篇关于2014财政年前两个月OGD行动的博文(【FDA仿制药办公室2013及2014财年行动 识林资讯 2014-01-05】)。今天,12月份的数据已经公布,令人大吃一惊!...
|

|
FDA发布GDUFA信息技术( IT )计划
2014.01.06
12月26日,FDA发布仿制药使用者付费法案(GDUFA)信息技术(IT)计划。该计划介绍了FDA在GDUFA绩效目标和2013至2017财年程序中描述的提高业务流程、数据质量和一致性、支持技术和IT运行的方法。对于FDA走向一个完全自动化的基于标准的环境以增强人用药的监管审评流程,FDA正在征求来自产业...
|

|
FDA仿制药办公室2013及2014财年行动
2014.01.05
FDA仿制药办公室公布2013及2014财年有关其工作量的行动
摘要
2013财年,OGD对申请人执行了150个“拒收(refuse-to-receive,RTR)”决定。药企撤回了107件ANDA申请。与2012财年的517件相比,OGD批准了440件ANDA申请,约下降15%。
OGD在2013财年收到了968件原始ANDA,比2012财...
|

|
Janet Woodcock致CDER员工的备忘录
2013.12.29
Janet Woodcock致CDER员工的备忘录
CDER各位员工:
2012年9月,随着仿制药用户费修正案(the Generic Drug User Fee Amendments of 2012, GDUFA)获得历史性通过,公众对仿制药空前关注,我宣布将仿制药办公室(Office of Generic Drugs, OGD)升格为一个“超级办...
|

|
【趣闻】弗罗里达交警:圣诞节向超速司机派发彩票
2013.12.27
弗罗里达州墨尔本市交警:圣诞节向超速司机派发彩票
佛罗里达州墨尔本市:大约30位超速的司机停靠后获得一份意外的惊喜:交警奉上的即开型彩票。
“我们正尝试一种有些不同的方式,” Jamie Rocque警官在接受《今日佛罗里达报》采访时表示。但Rocque表示,这些礼包中囊括了对...
|