|
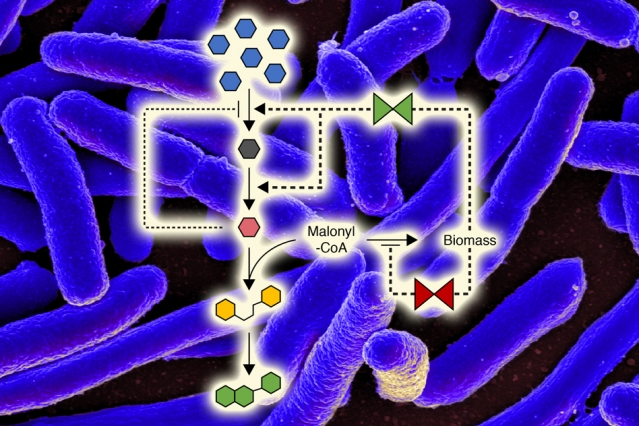
化学工程师找到控制微生物代谢的新方法可十倍提高产量
2019.12.10
为帮助优化细胞产生所需化合物的能力并保持其自身生长,麻省理工学院(MIT)的化学工程师设计了一种可以诱导细菌在不同时间不同代谢途径之间进行切换的方法。这些开关被编程到细胞中,并由种群密度的变化触发,无需人工干预。
这一研究于 12 月 3 日发表在《美国国家科学院院刊》(PN...
|
|
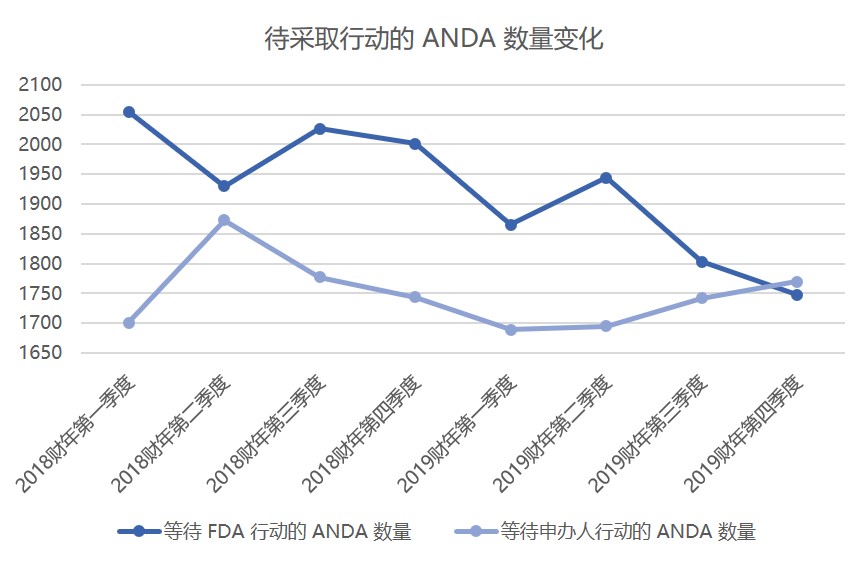
FDA 仿制药积压已清理,批准神话难持续?
2019.12.09
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 表示,近年来 FDA 接连创下仿制药批准数量记录的部分原因是大量申请积压。因此,由于 FDA 批准了现有积压的剩余部分,因此“可能不会保持”创纪录的年度仿制药批准。
Woodcock 于 12 月 3 日在 FDA/CMS 年会上表...
|
|
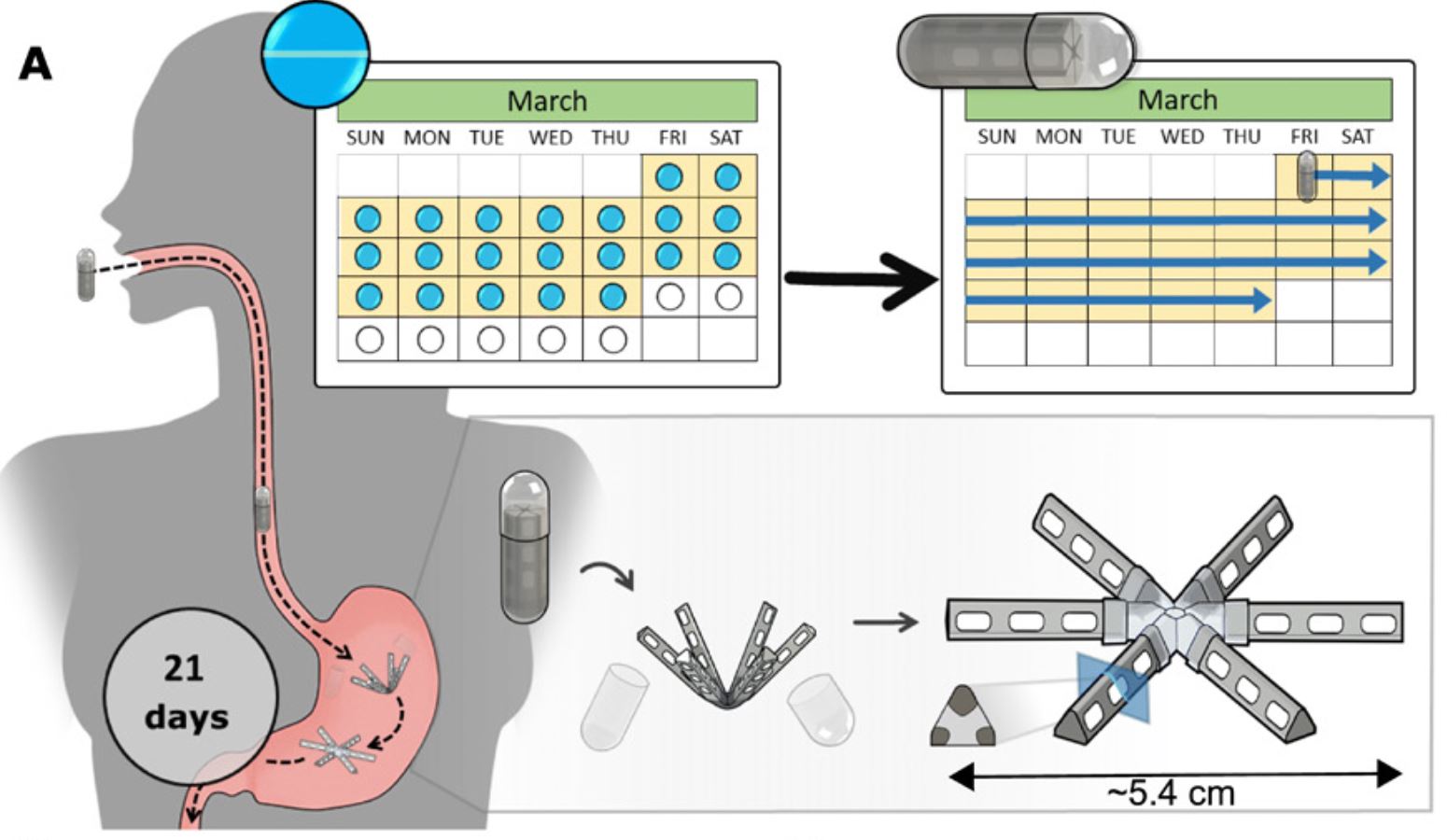
MIT 开发新型药物递送系统,口服避孕药一月仅需服一...
2019.12.09
美国麻省理工学院(MIT)研究人员正在开发一种每月只需服用一次的口服避孕药,可以减少由于忘记每天服用而引起的意外怀孕。这种新型避孕药装在有明胶图层的胶囊中,可以携带三周剂量的避孕药。吞咽后该胶囊保留在胃中,并逐渐释放药物。在猪身上的试验表明,这种药物释放可以达到与每日服...
|

|
FDA 拟启动新型辅料不关联审评试点计划
2019.12.06
美国 FDA 正在向业界征询有关通过独立审评程序来评估新型辅料安全性的试点计划的意见。业界支持者认为这一计划可以刺激急需新型辅料的发展。
辅料是在药品中使用并且有意添加的成分,但并不期望会产生治疗效果。新型辅料是从未使用过且“在 FDA 批准的药品中从未审评过或者未在食品...
|

|
FDA批准Gilenya的首仿药
2019.12.05
FDA approves first generics of Gilenya
For Immediate Release December 05, 2019
The U.S. Food and Drug Administration has approved three applications for first generics of Gilenya (fingolimod) capsules for the treatment of relapsing forms of multip...
|
|
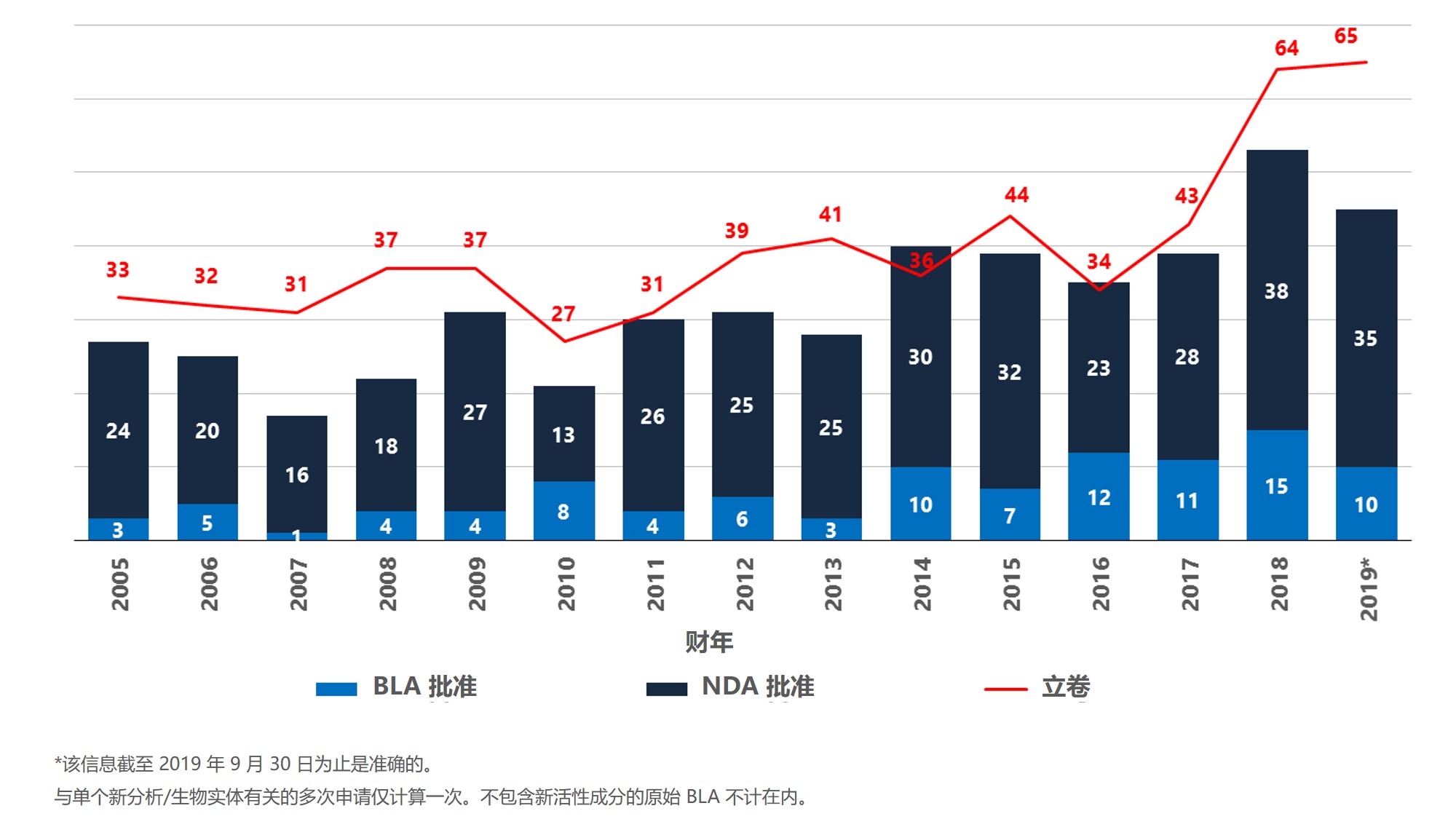
2019 年 FDA 新药审批情况一览
2019.12.05
2019 年 FDA/CMS 峰会于 12 月 3-4 日在美国弗吉尼亚州阿灵顿市召开。这是美国一年一度唯一一个将 FDA 与美国医疗保险和医疗补助服务中心(CMS)两个机构的高级和执行领导召集在一起的会议。会上 FDA 高级领导会向行业介绍与药物开发有关的当前发展、举措、变化和来年更新。CM...
|

|
阿达木单抗如何不通过临床数据而获得新青少年适应症
2019.12.05
2018年8月16日,FDA将阿达木单抗的给药方案扩展至治疗12岁及以上、体重至少达到30公斤的青少年化脓性汗腺炎(HS)患者,该批准并非从新的临床数据中得出,而是主要由模型引导(model-informed)药物研发途径提供支撑(具体给药方案如下表1所示)。2019年7月,FDA下属的药物研究机构发...
|

|
ICH Q12 指南定稿,更多新指南雏形初现
2019.12.04
ICH 在其最近于 11 月 16 日至 20 日举行的新加坡会议上定稿了三篇关键指南,其中包括备受争议的批准后变更生命周期管理指南 Q12,同时还敲定了一些新指南主题的概念文件和运行计划。识林在新加坡会议之前对 ICH 一些指南的进展做了简要报道,详见:【ICH 2019-2020 年指南制定进展...
|

|
一次糖尿病监测仪故障带给数字时代的警示故事
2019.12.04
医疗科技的成功也意味着新技术变得不可或缺而且不允许出错。想想看,你可以容忍微信、微博瘫痪的情况,但不能失去使孩子的血糖保持在安全水平的设备。
这是最近几天一家位于圣地亚哥的公司 Dexcom 刚刚发生的事情,该公司生产糖尿病患者使用的用来测量血糖的传感器。Dexcom 一直以来...
|

|
FDA 发布药品和生物制品临床适应性设计定稿指南
2019.12.02
美国 FDA 于 11 月 29 日发布《药品和生物制品临床试验适应性设计》定稿指南。指南为恰当地使用可能随着收集数据而发展的临床试验设计提供了建议。依据新的定稿指南,制药商能够在中期对临床试验进行适应性调整,以更好地开展药物研发及临床试验活动。
适应性设计临床试验允许根...
|

|
一家立志“转型制药研发”的初创公司的兴衰
2019.12.02
Enlight Biosciences 公司,一家由 PureTech 风投公司于 2008 年在波士顿成立的初创公司,曾得到多家大型制药公司的支持。与大多数生物技术初创公司不同,人们从未期望 Enlight 生产任何药物。相反,该公司计划发掘大量有前景的、与生物技术相关的想法(idea,或者说概念、点子)。Enl...
|

|
赛诺菲巴斯德谈疫苗开发面临的挑战及产品线
2019.11.29
最近赛诺菲巴斯德执行副总裁 David Loew 在一次采访中讨论了疫苗开发的挑战,他表示,疫苗开发过程涉及研究人员向健康人群中注射,因此找到一种既有保护作用又安全的疫苗非常困难。另外,他还指出,疫苗是资本密集型的,需要足够的生产能力才能为全世界供应疫苗。
Loew 表示,“当...
|

|
EMA 将采取措施避免药品审评过程中的偏见
2019.11.28
几个月前我们曾报道过欧洲监察使建议欧洲药品管理局(EMA)采取几项措施,以确保与制药商就上市申请进行的申报前会谈不会影响审批决定。【申报前会议可能给 EMA 审批过程带来偏见? 2019/08/16】现在故事有了新进展,EMA 宣布同意采纳欧洲监察使的建议。
EMA 在 11 月 21 日回应...
|

|
构建覆盖所有 FDA 行动和报告的单一数据库将有助于...
2019.11.28
美国 FDA 于 11 月 7 日召开“促进有效的药物研发计划:FDA 新药办公室的机遇与挑战”会议,向利益相关者请教有关如何改善药物研发过程的具体建议。会上药品审评与研究中心(CDER)新药办公室的 25 位领导人听取了 28 名发言人的演讲。
赛诺菲北美监管科学和政策负责人 Andrew Ro...
|
|
FDA 发布指南草案生物类似胰岛素将不再需要比较性免...
2019.11.27
美国 FDA 于 11 月 25 日发布《生物类似和可互换性胰岛素产品的临床免疫原性考量》指南草案,为美国市场开发生物类似和可互换性胰岛素产品的公司一般情况下将不需要开展比较性临床免疫原性研究。该指南草案预计将受到业界的大力欢迎。
指南指出,“当前用于评估胰岛素产品质量属...
|

|
【研究】FDA 在新药审评中使用的患者经验数据的分析
2019.11.27
“患者经验数据”(Patient experience data, PED)是指与患者的经验、观点、需求和优先重点相关的有意义数据的系统性收集。PED 可以在 FDA 对产品申请的审评中扩充传统临床试验数据。
10 月 9 日发表在 DIA《治疗创新与监管科学》杂志上的一篇研究文章分析了 FDA 在 2018...
|

|
美国科学院发布报告呼吁扩大药监机构之间的信息共享和...
2019.11.26
美国国家科学、工程和医学研究院(NASEM)召集的一个委员会于 11 月 21 日发布了一份《全球化世界中的药品监管:监管机构之间需要更多依赖》报告,概述了药监机构目前在全球范围内共享信息的方式,并提出了改善机构间关系的建议。
这份 112 页的报告是应美国 FDA 全球政策...
|
|
哈佛、MIT及一批行业领导者将联合开办生物制造工厂
2019.11.26
哈佛大学 11 月 25 日宣布,一批领先的波士顿地区大学、医院和公司将在波士顿市内或附近建立一个新的生物制造和创新中心,以期捍卫该地区在生命科学领域的领导地位。这一领导地位正受到生物制造方面严重瓶颈的威胁。
哈佛大学公共事务副校长 Kevin Casey 表示,该制造中心将于 20...
|

|
FDA 副局长谈全球政策和战略办公室及其工作重点
2019.11.25
每年有 136400 多家国外设施向美国出口 FDA 监管的产品,其中许多产品从发展中国家、新兴市场或通过跨国供应链进入美国。应对这种复杂性来确保美国进口的产品被正确地生产、处理和贮存是 FDA 面临的重大挑战。因为有 150 多个国家向美国出口产品,而每个国家都有自己的法律和标准...
|

|
FDA 努力帮助提高生物类似和可互换胰岛素产品的开发...
2019.11.25
Statement on efforts to help make development of biosimilar and interchangeable insulin products more efficient
For Immediate Release November 25, 2019
Statement From Acting Commissioner of Food and Drugs - Food and Drug Administration, ADM Brett P...
|