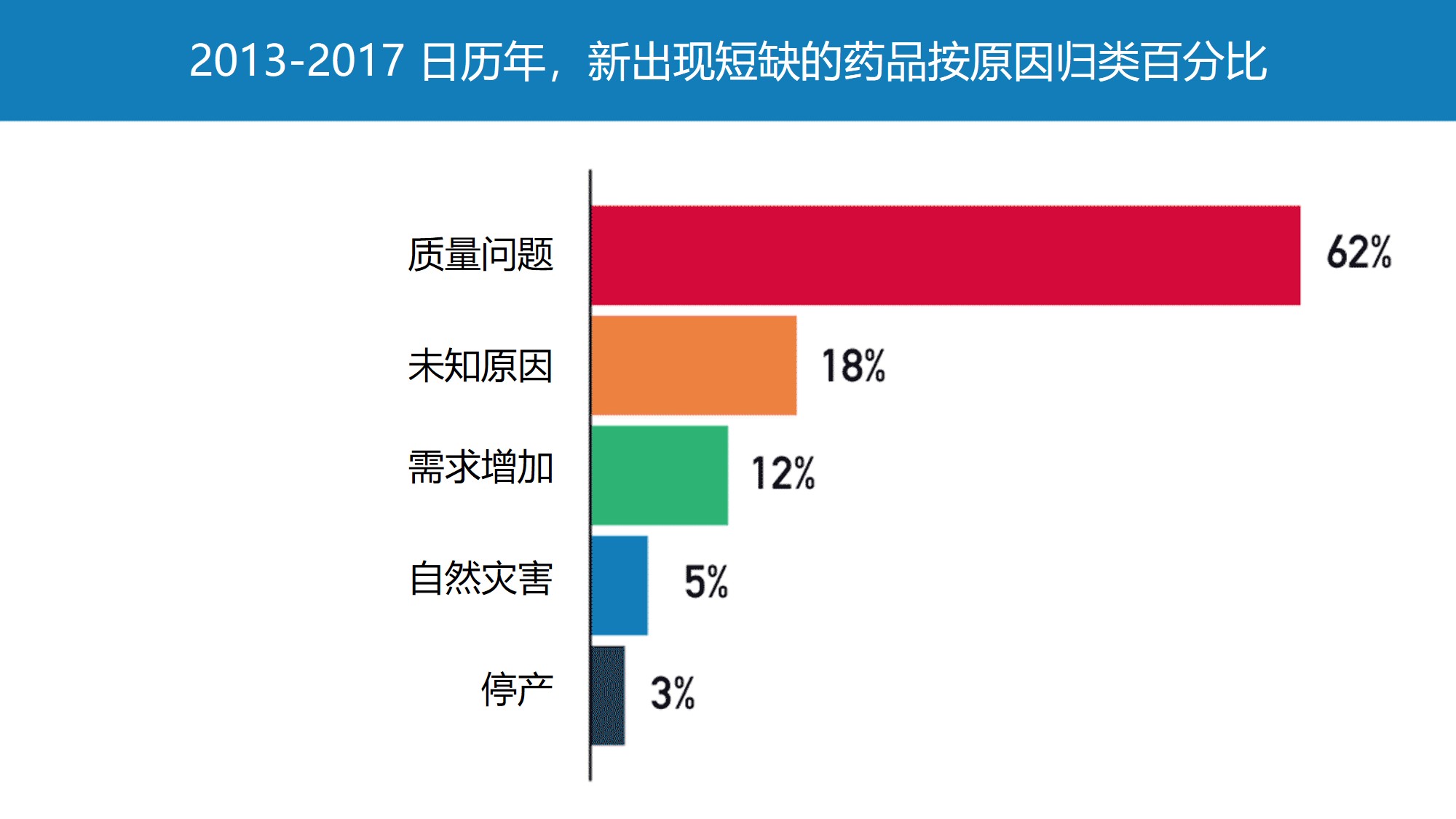
|
FDA 提出应奖励具有成熟质量体系的制药商以预防药品...
2019.10.26
美国 FDA 药品审评与研究中心主任 Janet Woodcock 于 10 月 24 日撰文表达了通过评级体系,采购方可以向具有成熟质量管理体系的生产商支付更多费用,以预防药品短缺的解决思路。她表示,消费者可能并不总是只根据最低价格购买商品。例如,如果消费者高度重视自己的时间,那么可能...
|
|
FDA 关于质量体系成熟度十大标志的建议
2019.09.02
8 月 12 -14 日在美国马里兰州 Cambridge 举行的“海边 GMP”年会上,美国 FDA 的合规部门鼓励制药公司确保他们展示“质量成熟度”,并提供有关 FDA 希望看到的具体内容。FDA 对于成熟质量体系的建议既适用于初创公司也适用于老牌制药商和申办人,既适用于制药企业也适用于医...
|

|
FDA 启动两个质量量度新项目
2018.06.19
更新:FDA 于 8 月 18 日宣布延长质量量度现场考察项目的申请提交日期。利益攸关者最初需要在 2018 年 8 月 28 日之前提交参与申请,由于业界对该计划感兴趣,申请提交日期将延长至 2018 年 12 月 17 日。
【编者按】质量量度概念自 2013 年提出至今已有五年的时...
|

|
FDA持续推进质量量度计划
2018.04.26
尽管近期公告和业界关注比较少,但FDA药品质量办公室(OPQ)主任Michael Kopcha表示,质量量度计划并没有停止。
Michael Kopcha在4月11日FDA仿制药论坛上表示,质量量度计划对于FDA和现代制造业的发展仍然很重要,无论对于其本人、对于OPQ,还是对于FDA都是具有优先级的事情。当局...
|

|
FDA 表示质量量度需要反馈而不是反对
2017.07.24
美国 FDA 的质量量度计划已经到达令人沮丧的时刻,这在近日国际制药工程协会(ISPE)、FDA 和药品质量研究学会(PQRI)联合举办的质量制造会议上显而易见。
在 ISPE 质量会议的开始,FDA 药品质量办公室(OPQ)主任和名誉会议主席 Michael Kopcha 斥责大部分企业反对计划而不...
|

|
FDA在检查观察项中引用“无效的OOS率”
2017.07.05
美国 FDA 在向印度一家制造商签发的 483 中提到无效的 OOS 率过高,这是 FDA 提出用于评估药品制造设施质量量度的三个指标之一。这可能表明,即使行业迫使 FDA 延迟其质量量度计划,FDA 仍然可以并将通过检查过程来对其提出的指标开展性能评估。
FDA 在一份检查观察项的 483...
|

|
工业界呼吁FDA暂停质量量度计划
2017.04.05
制药行业组织因担心高成本和低收益问题,正在呼吁 FDA 暂停推进其质量量度计划。这项建议由代表品牌药、仿制药和原料药公司的各种团体组织提出,以单独或行业联盟的形式提交评议(https//www.regulations.gov/docket?D=FDA-2015-D-2537 FDA-2015-D-2537)。其中之一,代表...
|

|
2017 PDA药品质量量度和质量文化会议简报
2017.02.23
【编者按】FDA/CDER Woodcock主任2013年提出质量量度概念,掀起业内广泛关注和积极相应,但统一产业界各方利益以及FDA内各部门认知并非易事,质量量度的发展缓慢。但在FDA和产业界共同的探索质量量度征程中,呈现了很多值得我国借鉴的视角和方法、经验和教训,有助于用他山之石攻己之...
|

|
对FDA质量量度指南草案(2016版)的反馈意见
2017.01.24
2016年11月25日,FDA发布了质量量度指南草案的第1版修订稿(称“2016版指南”),与2015版有较大变化。北京大学药物信息与工程研究中心翻译了该指南,并向国内业界收集反馈意见。征求意见原截止于2017年1月24日,中心现已向FDA正式提交反馈意见,中英对照稿详见下文。
考虑到FDA将征求...
|

|
FDA 2016版质量量度指南中文翻译出炉
2016.12.07
2015年7月28日,FDA在联邦公报上公布了《质量量度要求》指南草案(2015版)并公开征求意见。北京大学药物信息与工程研究中心翻译发布了指南草案的中文稿,并向国内业界征集意见,汇总整理后向FDA正式提交了反馈。
2016年11月23日,FDA发布了质量量度指南草案的修订稿《提交质量量度数据...
|

|
FDA 2016版质量量度指南要求提交的量度详解 - III
2016.12.04
2015年7月,FDA发布了质量量度(QM, Quality Metrics)指南(称“2015版指南”)草案供业界评议。FDA期望所有参与制剂和API加工的设施都上报产品的质量量度数据。在充分考虑了业界提出的意见后,FDA于近日发布了质量量度指南草案的第1版修订(称“2016版指南”),该版本与2015版相比有...
|

|
FDA 2016版质量量度指南要求提交的量度详解 - II
2016.12.03
2015年7月,FDA发布了质量量度(QM, Quality Metrics)指南(称“2015版指南”)草案供业界评议。FDA期望所有参与制剂和API加工的设施都上报产品的质量量度数据。在充分考虑了业界提出的意见后,FDA于近日发布了质量量度指南草案的第1版修订(称“2016版指南”),该版本与2015版相比有...
|

|
FDA 2016版质量量度指南要求提交的量度详解 - I
2016.11.30
2015年7月,FDA发布了质量量度(QM, Quality Metrics)指南(称“2015版指南”)草案供业界评议。FDA期望所有参与制剂和API加工的设施都上报产品的质量量度数据。在充分考虑了业界提出的意见后,FDA于近日发布了质量量度指南草案的第1版修订(称“2016版指南”),该版本与2015版相比有...
|

|
FDA发布质量量度指南草案修订版,将启数据收集计划
2016.11.27
2015年7月,FDA发布了质量量度(QM, Quality Metrics)指南(称“2015版指南”)草案供业界评议。在充分考虑了业界提出的意见后,FDA于近日发布了质量量度指南草案的第1版修订(称“2016版指南”),该版本与2015版相比有较大形式和内容的变化。以我们的观察,QM指南在未来几年内可能都...
|

|
FDA发布质量量度数据填报技术标准文件
2016.06.25
FDA于2016年6月24日发布了质量量度数据填报技术标准文件Quality Metrics Technical Conformance Guide,作为2015年7月28日发布的质量量度指南草案的一部分。这份10页的技术文件详细描述了质量量度指南草案所要求数据的填报格式和字段。FDA建议质量量度数据通过可扩展标记语言(XML,Exten...
|

|
ISPE发布质量量度二期试点报告
2016.06.10
在2016年6月6日至8日的国际制药工程协会(ISPE,International Society of Pharmaceutical Engineering)、FDA和药品质量研究学会(PQRI,Product Quality Research Institute)联合举办的质量制造会议上,ISPE发布了质量量度二期试点报告。ISPE的质量量度二期试点继续与国际知名的...
|

|
北京大学质量量度一期研究报告会简报
2015.12.03
2015年11月21日,北京大学质量量度课题组一期研究报告会在北京大学举行。课题组共同组长、厚普(北京)国民健康研究中心主任许琪介绍研究背景,课题组共同组长、北京大学药物信息与工程研究中心主任郑强汇报研究成果。来自制药企业、行业协会、监管机构、政府招标和采购部门、医院、医药电...
|

|
对FDA质量量度指南草案的反馈意见
2015.12.01
【编者按】北京大学药物信息与工程研究中心(以下简称“中心”),多次代表我国出口药企对美国FDA的法规政策制定正式地提出具体意见和建议。按照美国法律,FDA制定政策需要征求主要利益攸关方的意见。我国药企作为美国市场原料药的主要供应商,自然是主要利益攸关方。将我国药企的看法,...
|

|
质量量度:房屋表观结构与内在管道系统
2015.11.14
编者按:来自业内权威咨询机构Lachman Consultant的专家Linda Evans O'Connor对今年11月ISPE美国年会上FDA提出正在考虑对质量量度的“管道测试(Testing the plumbing)”提起了关注,并建议企业参加测试计划。房外和房内墙壁里面以及房屋下面的上下水管道、通风和冷热器管道、电...
|

|
FDA-北京大学质量量度专题报告会及CMC与GMP统计课程...
2015.10.23
10/24更新
昨接到FDA通知,因美国国会与行政部门间内部预算协商问题,FDA决定取消11月的中国之行。故原定11月17日上午的“FDA-北京大学质量量度专题报告会”活动只能取消。我们已建议FDA将计划讲的内容制成录像,以便我们提供给大家免费下载。给大家带来不便,非常抱歉!
(注:1...
|