|
FDA 更新早期阿尔茨海默病药物开发指南,增加对生物...
2024.03.13
美国 FDA 于 3 月 11 日发布“早期阿尔茨海默病:治疗药物的研发”修订指南草案,描述了 FDA 目前关于使用生物标志物来选择患有早期阿尔茨海默病参与者参加试验的想法。
该指南草案是 FDA 于 2018 年 2 月发布草案的修订版,是为考虑开发用于患者发展为明显痴呆之前的散发...
|

|
FDA 要求召开外部专家会讨论礼来阿尔茨海默药 donane...
2024.03.12
礼来于 3 月 8 日表示,美国 FDA 将召开外部专家会讨论其阿尔茨海默病药物 donanemab 是否应该获得批准。
Donanemab 在去年的 III 期试验中取得了成功,与安慰剂相比,阿尔茨海默病的进展速度减缓了 35%。但礼来表示,FDA 预计将召开专家会来审查该试验,并表示,FDA“希望进...
|
|
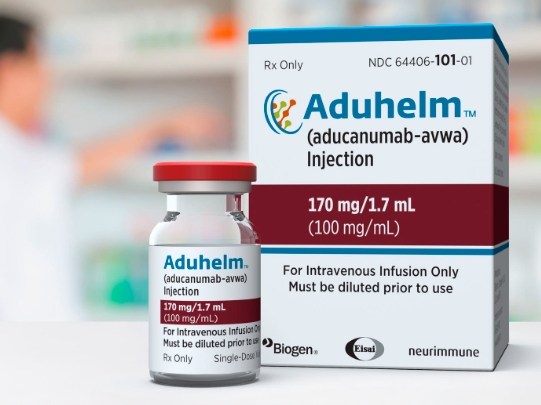
渤健决定放弃对有争议的阿尔茨海默药 Aduhelm 的所...
2024.02.01
渤健(Biogen)于 1 月 31 日表示,将放弃对阿尔茨海默病药物 Aduhelm 的所有权,发明 Aduhelm 的瑞士公司 Neurimmune 将重新获得该药的全部权权利。渤健还将终止一项关于 Aduhelm 的正在进行的临床试验,该试验旨在证明该药对早期阿尔茨海默病患者的获益。
渤健首席执行官 Christop...
|

|
FDA 专家会全票支持完全批准卫材阿尔茨海默新药,建...
2023.06.12
美国 FDA 于 6 月 9 日召开的专家会上,专家小组成员一致投票赞成扩大对卫材和渤健(Biogen)阿尔茨海默病治疗药 Leqembi 的批准,从加速批准转化为完全批准。
专家小组以 60 一致认可 Leqembi 在 1800 名患者中的研究证实了其对阿尔茨海默病早期患者的获益,建议 FDA 扩...
|

|
礼来阿尔茨海默新药三期研究显示患者认知能力下降速度...
2023.05.04
礼来公司于 5 月 3 日表示,其开发的阿尔茨海默病新药 donanemab 在一项 III 期试验中,与安慰剂相比,可使患者的认知和功能下降速度降低 35%,这为向美国 FDA 提交申请铺平了道路。
但 donanemab 研究的积极结果也许会因两名患者(可能还有第三名患者)因该药引起脑肿胀...
|
|
礼来solanezumab阿尔茨海默病十年长期随访试验宣告失...
2023.03.10
礼来阿尔茨海默病药物 solanezumab 于 2013 年开始的一项对患者进行了 10 年随访的试验最近宣布并未显示对患者有任何获益。
礼来的研究招募了大约 1100 名年龄在 65 至 85 岁之间的患者,他们尚未表现出临床损伤的迹象,但脑成像扫描显示淀粉蛋白斑块积聚,这是阿尔茨海默...
|
|
FDA 加速批准新阿尔茨海默药,医保覆盖前景如何?
2023.01.09
美国 FDA 于 1 月 6 日加速批准了卫材和渤健的新阿尔茨海默药 Leqembi(lecanemab-irmb),该药可适度减缓早期疾病患者的认知能力下降。
阿尔茨海默病专家表示,Leqembi 为轻度认知障碍或早期阿尔茨海默病患者提供适度的获益,同时会带来一些需要监测的大脑肿胀和出血风险。但...
|
|
美国众议院调查报告建议 FDA 修订申办人互动和阿尔...
2023.01.04
上周我们报道了美国众议院两委员会联合对渤健阿尔茨海默药 Aduhelm 审批和定价过程的调查报告,揭示了 FDA 存在的一些不恰当行为以及企业的贪婪。报告中的发现引起了人们对 FDA 在程序方案方面的失误以及渤健在 Aduhelm 批准过程中无视疗效和可及性的严重关切。这些发现也证明了专...
|

|
美国众议院关于阿尔茨海默新药的调查报告中未回答的问...
2023.01.04
上周发布的美国众议院两委员会联合对渤健阿尔茨海默药 Aduhelm 审批和定价过程的调查报告,揭示了 FDA 存在的一些不恰当行为以及企业的贪婪,同时也给出了一些建议。但对于 FDA、渤健以及阿尔茨海默病治疗药的未来,一些资深专家指出报告未在几个重要方面给出答案。
1. FDA 有...
|

|
美国众议院委员会发布对渤健阿尔茨海默药 Aduhelm ...
2022.12.30
美国众议院监督和改革委员会和能源与商业委员会在对 FDA 关于渤健(Biogen)的阿尔茨海默药 Aduhelm 的监管审评和批准程序以及渤健对 Aduhelm 的定价进行了为期 18 个月的调查,整理了超过 50 万页来自 FDA 和渤健的文件后发布了一份46 页的工作人员报告。随报告一同发布的还有...
|
|
ICER 公布渤健和卫材以及礼来两款最新阿尔茨海默药成...
2022.12.29
美国临床与经济评价研究所(ICER)于上周发布的一份分析草案指出,卫材和渤健(Biogen)公司最新的阿尔茨海默病治疗药 lecanemab 每年需要低于 2 万美元才能具有成本效益。
ICER 深入研究了 lecanemab 的证据并得出结论认为,根据该药已证明的获益 — 适度但具有统计学意义的...
|

|
渤健卫材阿尔茨海默新药详细数据发布,希望与问题相伴
2022.12.01
11 月 29 日,渤健和其合作伙伴卫材在阿尔茨海默病临床试验大会上介绍了其备受关注的研究性阿尔茨海默药 lecanemab 的详细 3 期临床数据,这一数据同时在《新英格兰医学杂志》(NEJM)上发表1。
专家表示卫材在会议上的演讲或许打消了人们对于 lecanemab 是否能成功的担忧,同...
|
|
罗氏阿尔茨海默药 gantenerumab 两项3期临床试验失...
2022.11.16
瑞士制药商罗氏于 11 月 14 日披露,其抗淀粉样蛋白药物 gantenerumab 在两项早起阿尔茨海默病 III 期试验中失败,不仅没有达到减缓临床衰退的主要终点,β-淀粉样蛋白的去除水平也低于预期。
罗氏在新闻稿中表示,与安慰剂相比,gantenerumab 分别减缓了 8% 和 6%...
|
|
渤健卫材另一阿尔茨海默治疗药最新临床试验显示可减缓...
2022.09.29
渤健和卫材于 9 月 28 日早上宣布,其正在开发的另一阿尔茨海默新治疗药 lecanemab 在临床试验中将认知能力下降的速度减缓了 27%,达到主要研究目标,为该药预期在明年 1 月份的批准决定增加了强有力的支持性证据。
这一消息对于两年多以来因阿尔茨海默治疗药 Aduhelm(aducanu...
|

|
研究显示 FDA 加速审批计划整体达到预期目标
2022.09.02
1992年,为了应对艾滋病的流行,FDA制定了加速审批(accelerated approval)政策。2012年,加速批准途径被美国国会纳入法规,用于“加速”治疗危重疾病的药物进入临床。
在快速批准中,药物是否通过审批通常是以替代终点作为依据,FDA将其描述为“一种标记物,例如实验室测量值、放射...
|
|
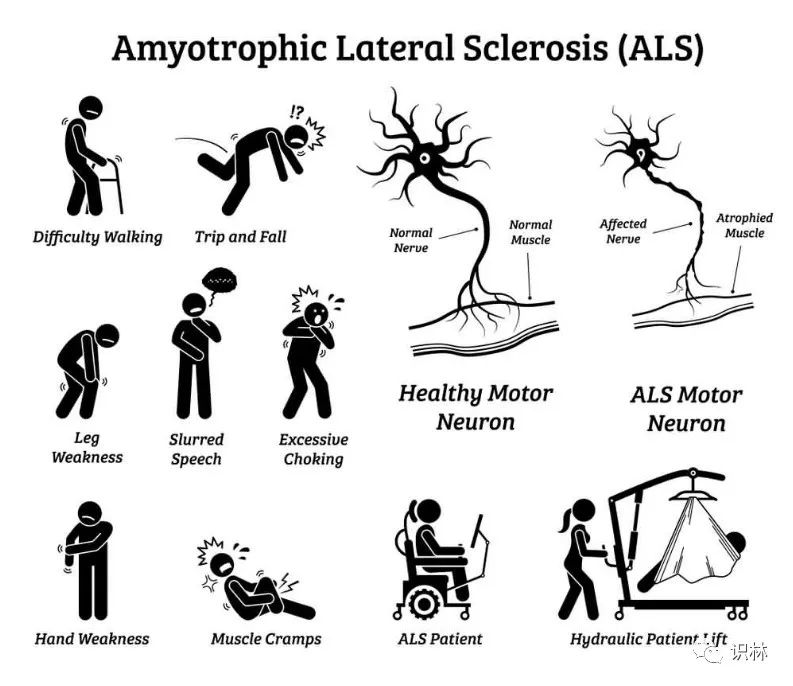
期望、争议与不同命运,ALS和AD药物的研发与审评概览
2022.04.28
备受争议的 Aduhelm 获得 FDA 加速批准上市,批准后仍争议声不断【渤健阿尔茨海默药再遇挫:政府医保将覆盖范围限定在临床试验内】。Aduhelm 的批准引发的争议已波及到该疾病领域之外,肌萎缩侧索硬化症(ALS)倡导者对 FDA 在 ALS 领域的缓慢行动感到不满。
外周和中枢神经...
|
|
Aduhelm 的困境:美国多所顶级医院表示不提供有争议...
2022.01.08
渤健(Biogen)备受争议的阿尔茨海默药 Aduhelm 最近又被推上了争议的顶峰,克利夫兰诊所等主要医疗保健系统明确表示他们不会开出这种药,理由是该药缺乏令人信服的有助于治疗阿尔茨海默病的证据。另外还有包括约翰霍普金斯大学、加州大学洛杉矶分校和密歇根大学在内的 15 家大学附属...
|
|
渤健阿尔茨海默药 Aduhelm 降半价,能否进政府医保...
2021.12.22
渤健(Biogen)于 2021 年 12 月 20 日宣布,将其备受争议的阿尔茨海默药 Aduhelm 的价格降低一半,从 56,000 美元降至 28,000 美元。这一举动大大出乎人们的意料,但细想下来也似乎在情理之中。
这一大幅降价标志着渤健的一些策略上的转变。之前,渤健正在努力扭转 Aduhe...
|
|
渤健将启动阿尔茨海默药 Aduhelm 大型确证性试验,...
2021.12.17
渤健(Biogen)于 2021 年 12 月 16 日表示,预计将于明年 5 月启动一项大型临床试验,以确证阿尔茨海默治疗药 Aduhelm 的获益。该试验的执行是 Aduhelm 获得美国 FDA 加速批准的条件之一,可以回答一些悬而未决的问题。但渤健表示需要数年时间才能展示其数据。
渤健表示...
|
|
欧洲监管机构表示渤健阿尔茨海默病新药 Aduhelm 不...
2021.11.18
渤健(Biogen)于 2021 年 11 月 17 日公布,一个欧洲药物审评小组通知渤健,其阿尔茨海默病治疗药 Aduhelm 不太可能在欧洲获得批准。Aduhelm 在欧洲药品管理局(EMA)的口头解释听证会之后收到了来自 EMA 专家的“负面投票”。
在 11 月 9 日举行的口头解释听证会上,...
|