|
FDA 使用真实世界证据证实窄治疗指数仿制药的临床等...
2020.10.05
昨日的文章【周末杂谈:仿制药是无名英雄】介绍了仿制药花 20% 的钱干 90% 的事,既然仿制药如此优越,如何促进仿制药的使用呢?美国 FDA 一直以来不断强调仿制药的监管使用的是与品牌药一样严格的标准,但是患者和处方医生对药品质量的感知仍然对仿制药的临床应用有着很大影响。...
|

|
【周末杂谈】仿制药是无名英雄
2020.10.04
仿制药花20%的钱做90%的事,创新药花80%的钱做10%的事
这周三在美国国会听证会上,众议员Katie Porter质询Celgene药企总裁Mark Alles,有如下一段对话。
议员:你的畅销药Revlimid(瑞复美,治疗多发性骨髓瘤等疾病),2005年上市时一片卖 $215,2013年卖 $412,2017年卖 $7...
|

|
FDA 发布基于生理学的药代动力学(PBPK)分析指南草...
2020.10.03
美国 FDA 于 9 月 29 日发布《基于生理学的药代动力学分析的使用 — 用于口服药品开发、生产变更和控制的生物药剂学申请》指南草案,提供了有关研究用新药申请(IND)申办人、新药申请人和简化新药申请人在开发、评估和使用基于生理的药代动力学(PBPK)的一般性建议。
PBPK ...
|

|
七名前 FDA 局长联名呼吁美国政府停止对 FDA 信誉...
2020.10.02
继半个月前八名 FDA 现职专业负责人联名发表声明承诺基于科学的决策之后【FDA 专业负责人联名承诺:科学至上】,七名前任 FDA 局长于 9 月 29 日在《华盛顿邮报》的观点文章1中联名呼吁停止政府对 FDA 信誉的破坏。科学家应根据数据做出决策,不受政治压力或意识形态或既得利益...
|
|
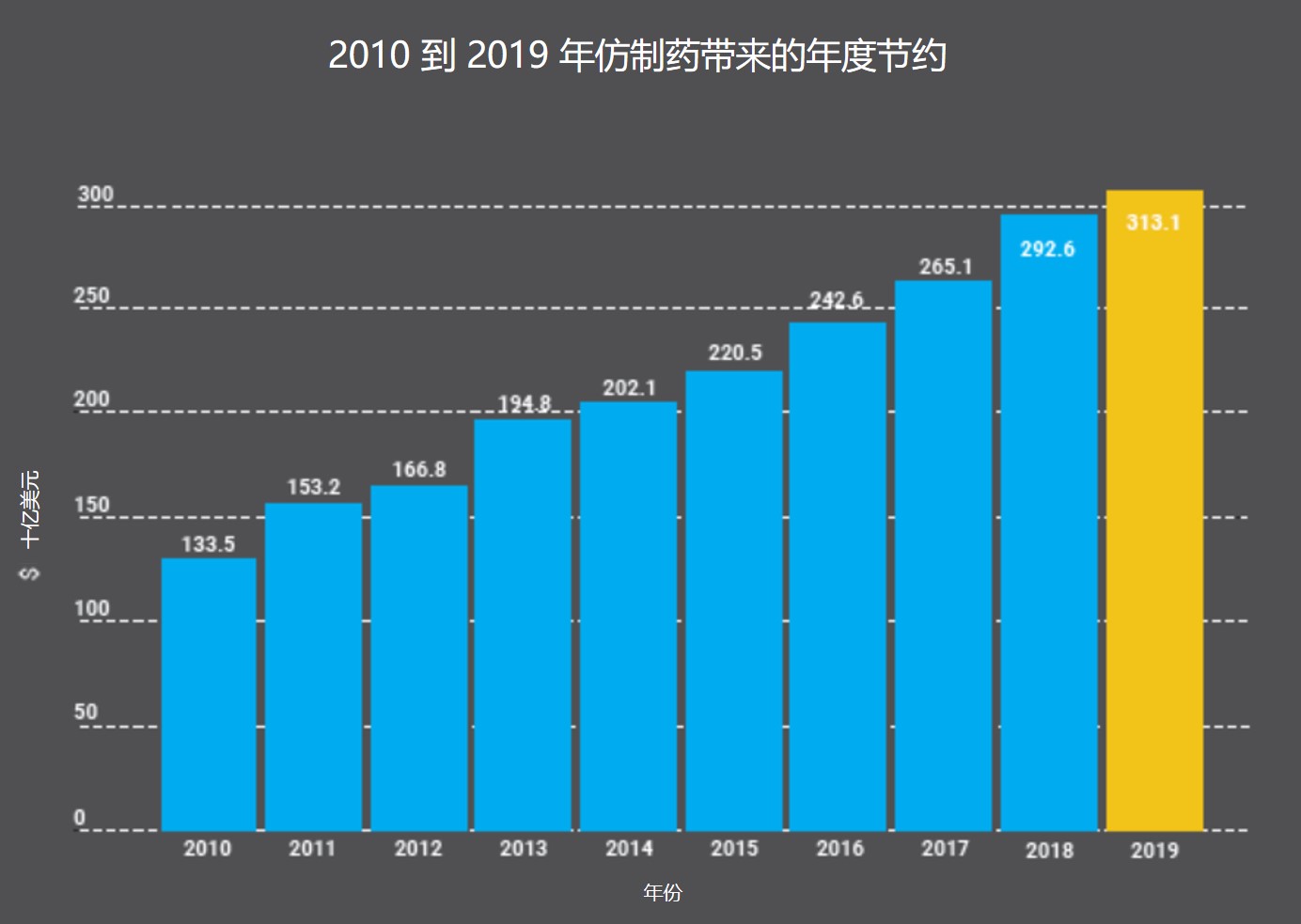
2020 美国仿制药和生物类似药节约报告
2020.10.02
美国普享药协会(AAM)近日发布了《2020 仿制药和生物类似药可及性与节约报告》,概述了这些产品在 2019 年为美国消费者带来的节约。
AAM 作为仿制药行业协会,连续十多年来每年都会发布关于仿制药和生物类似药节约的报告,向立法者和公众汇报关于仿制药的一些关键数据。报告中的数...
|

|
FDA 暂时批准的 ANDA 如何及时获得最终批准?
2020.09.30
美国 FDA 于 9 月 28 日发布定稿指南《ANDA 递交 – 暂时批准 ANDA 的最终批准增补和请求》,指南为需要对暂时批准的仿制药进行 ANDA 增补的申办人提供建议,指南范围包括寻求最终批准的增补申请。
除了一些技术上的澄清外,该定稿指南总体上遵循了 2019 年 1 月的草案版...
|

|
英国 MHRA 发布指南对生物类似药比对研究要求减负
2020.09.30
英国药品与医疗保健产品监管机构(MHRA)发布了一篇生物类似药指南草案,旨在通过取消大多数情况下对于比对有效性试验的需求,减少对生物类似药提交的临床试验数据的需求。MHRA 提出,如果有足够的比对分析和功能性数据,通常就不认为需要进行比对有效性试验,因此对生物类似药的临床有效...
|

|
临床试验中关于人工智能干预措施的报告共识标准
2020.09.29
一项新的共识声明“CONSORT-AI 扩展”为涉及人工智能(AI)干预措施的临床试验报告制定了规则。CONSORT-AI 全称为合并的报告试验标准-人工智能(Consolidated Standards of Reporting Trials–Artificial Intelligence)扩展是一项新的报告指南,用于评估具有 AI 成分的干预措...
|

|
FDA 发布关于 ANDA 完全回应函延期回复的指南草案
2020.09.29
美国 FDA 于 9 月 28 日发布《在监管期限内未能回复 ANDA 完全回应函》的行业指南草案,旨在帮助提交简化新药申请(ANDA)申请人请求延长对 FDA 完全回应函(CRL)的回复。指南描述了 ANDA 申请人在 CRL 发布后必须采取的行动,以及如果申请人未能对 CRL 做出回复 FDA 可能...
|

|
【一周回顾】2020.09.21-09.27
2020.09.28
ICH Q3D(R2)新增附录 5 说明关于皮肤和透皮给药路径元素杂质限度的考虑。识林新收录 WHO 药品和疫苗预认证内容。欧盟发布基于患者登记的研究指南草案。药审中心征求境外已上市境内未上市化学药品药学研究与评价技术要求。FDA 要求苯二氮䓬类药物的标签变更;新增大麻二酚 BE ...
|
|
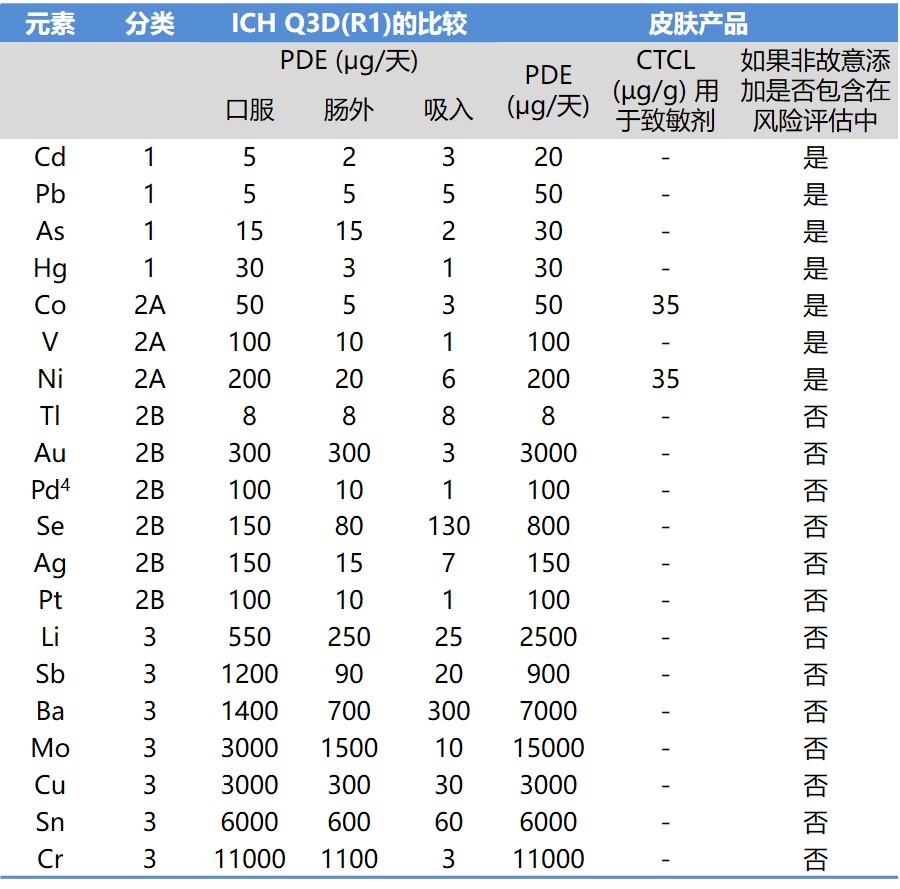
ICH Q3D 指南新增皮肤和透皮产品元素杂质限度附录
2020.09.28
ICH 于 9 月 25 日发布 Q3D 新附录 5 说明了关于皮肤和透皮给药路径元素杂质限度的考虑。附录介绍了如何通过将皮肤修饰因子(CMF)应用于每个元素杂质的肠外每日最大允许暴露量(PDE)来计算出所有相关元素杂质的皮肤 PDE。
附录适用于局部或全身作用的皮肤和透皮药品。不适...
|

|
【周末杂谈】规章的起草说明
2020.09.27
起草说明详述了FDA规章的来龙去脉和斟酌思考
这周三,FDA发布了两项拟议修订规章(21 CFR 201和801),澄清FDA是如何看待,因医生标签外用药或器械,企业是否要相应地修改产品标签【FDA 发布拟议法规澄清与标签外使用判定相关的证据】。这是个重要问题。众所周知,美国医生标签外用药...
|

|
欧盟发布基于患者登记的研究指南草案
2020.09.26
欧洲药品管理局(EMA)于 9 月 24 日发布有关基于患者登记的研究指南草案,为在药品许可前和许可后阶段使用患者登记提供了详细的建议。
基于患者登记的研究(Registry-based study)是一个或多个新的或现有登记库的基础结构对研究问题进行调查,以招募患者和收集数据。基于登记的...
|
|
FDA 发布拟议法规澄清与标签外使用判定相关的证据
2020.09.25
美国 FDA 在 9 月 23 日发布了一项新拟议法规,描述了在确定医药产品“预期用途(intended use)”时应考虑的证据类型。新法规将取消“整体证据”标准,并规定制药商对产品未获批用途的了解本身并不意味着该制药商打算将其用于该用途。拟议法规还提供了 FDA 在确定制药商是否打算...
|

|
如何避免瑞德西韦孤儿药认定的乌龙再次发生?
2020.09.25
不知大家是否还记得吉利德(Gilead)公司的瑞德西韦(remdesivir)曾短暂获得美国 FDA 孤儿药认定,但几天之后吉利德主动提出撤销请求。【众说纷纭:瑞德西韦孤儿药认定的授予与撤销请求 2020/03/26】这件事可能上了很有意义的一课,监管者需要更大的灵活性来管理孤儿药计划,包括之...
|

|
FDA 列举可因数据完整性而拒审的情况并给出补救建议
2020.09.24
美国 FDA 官员在 9 月 10 日非肠道药协会(PDA)举办的会议上解释了他们在做出拒绝批准与公司数据完整性漏洞有关的新药申请决定方面的某些情形,并介绍了解决此类问题的成功策略要素。
FDA 药品审评与研究中心(CDER)合规办公室(OC)生产质量办公室药品质量处高级政策顾问 Brooke ...
|

|
美国众议院通过法案建立国家连续制造卓越中心
2020.09.24
美国众议院于 9 月 21 日批准了建立连续制造卓越中心的立法,法案题为《2019 国家连续药物制造卓越中心》,该法案授权 FDA 认定国家连续制造卓越中心(NCE),卓越中心将与 FDA 和工业界合作,为连续制造实施制定国家框架,包括支持这项技术的额外研发、劳动力发展、标准化以及与...
|

|
罕见病临床试验网络建设:FDA 加速器计划及反馈意见
2020.09.23
【编者按】罕见病是人类面临的共同难题,目前的挑战包括患者人数少难以招募受试者,疾病变异性以及进展了解有限,罕见病治疗药物监管政策缺乏协调等等。美国 FDA 在建设罕见病临床试验网络方面的筹备和意见反馈或许对我们也同样有借鉴意义。
过去十年中,在规划和执行罕见病药物开...
|
|
PDA 细胞产品冻存实践现状调研分析
2020.09.23
第一批成功的冻存研究是在 1949 年开展的1,此后,许多策略被提出并予以采纳,来促进冻存后细胞功能的快速复苏。但可惜的是,尽管经过数十年的研究并在临床上得到了越来越多的重视,但目前仍没有针对细胞和基因治疗药物(先进治疗产品或 ATMP)协调一致的冻存标准,并且在商业和学术团...
|
|
首个新冠疫苗获批后,其它试验如何维持安慰剂对照?
2020.09.22
美国 FDA 官员正在考虑如何确保即使在一款新冠疫苗成功获得监管许可后,仍然可以继续进行针对新冠疫苗候选者的随机、安慰剂对照 III 期临床试验。一旦 FDA 批准或紧急使用授权了新冠疫苗,试验受试者的招募可能会变得更加困难,已经入组的受试者可能希望退出试验转而接受已被证明有...
|