|
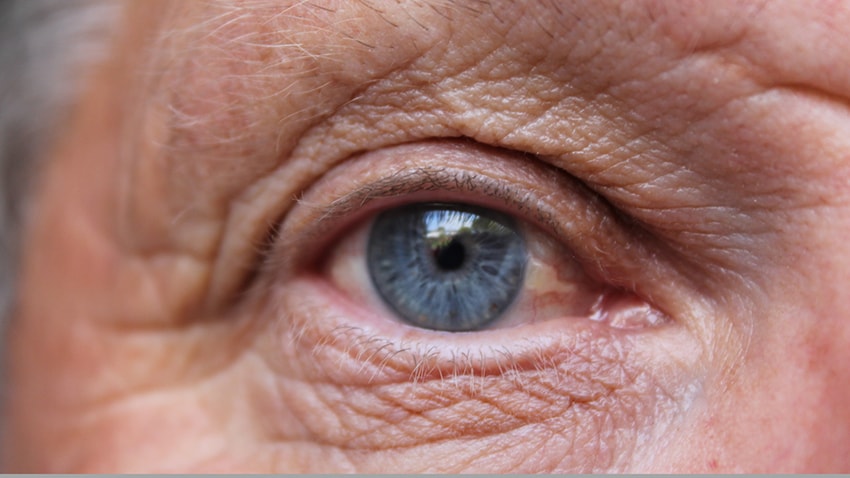
人工智预测老年黄斑变性进展,帮助筛选临床试验最佳受...
2020.05.22
标志着预测疾病进展的重大进步,并可能有助于开发更有效的药物。
人工智能(AI)已经显示出通过分析医学图像来检测和诊断眼部疾病的能力不断增强。由谷歌和英国医生开发的新系统通过预测哪些具有共同病症的患者最有可能失明,在 AI 预测眼部疾病的道路上迈出了重要一步。
5 月 1...
|
|
美国药品制造回归道路上的“绊脚石”
2020.05.21
政府大手一挥签了合同,但法定监管流程不是一两个月就能解决的。
识林在昨日的资讯中报道了美国政府给一家成立才 4 个月的药企 Phlow 3 – 8 亿美元的合同,提供用于治疗新冠疾病(COVID-19)的基本药物,并且还将为美国提供国家短缺原料药储备库提供和生产原料药(API),为此 P...
|

|
瑞士全球卫生产品上市许可程序,加快获得WHO预认证和...
2020.05.21
有 WHO 预认证或中低收入国家出口需求和计划的企业可以了解一下
近日,瑞士药品管理局(Swissmedic)根据全球卫生产品上市许可(Marketing Authorization for Global Health Products,MAGHP)批准了 Ferring 公司用于预防子宫出血的药物上市许可,标志着这一在中低收入国家(LM...
|
|
美国在药品制造回归上迈出了一大步
2020.05.20
政府给一家成立才4个月的药企3-8亿美元,回迁在中国和印度生产的原料药和仿制药。
美国联邦政府已与弗吉尼亚州的一家新公司 Phlow 签署了一份 3.54 亿美元为期四年的合同,生产治疗新冠疾病(COVID-19)所需的仿制药和原料药,成为其推动制药业重回美国的举措之一。
该合同由...
|

|
FDA 寻求制药商参与质量基准研究
2020.05.20
美国 FDA 一直以来都没有放弃探索如何评价和实施质量量度计划,而且试图从业界和学术界的试点和研究中获得更多知识,以期找到可行之路。今日,FDA 发布公告,就其资助的药品质量管理体系当前状态的研究,寻求制药商的参与。
FDA 表示,制药商可以通过标准化的质量基准研究(Quality B...
|

|
适应性试验大热,FDA 复杂创新试验设计试点提供学习...
2020.05.19
5 月 13 日,药审中心发布《药物临床试验适应性设计指导原则》征求意见稿,旨在厘清药物临床试验中适应性设计的相关定义,明确适应性设计在临床试验中的注意事项和适用范围,以期为工业界利用适应性设计支持药物研发和注册上市提供科学可行的指导意见。指导原则梳理介绍了几种常用的适...
|

|
EMA 表示将很快就瑞德西韦有条件上市许可做出决定
2020.05.19
欧洲药品管理局(EMA)执行主任 Guido Rasi 表示,EMA 可能很快做出决定是否许可吉利德(Gilead)公司的瑞德西韦(remdesivir)用于治疗新冠疾病(COVID-19)患者。
Rasi 于 5 月 18 日对欧洲议会的环境、公共卫生和食品安全委员会(ENVI)表示,“根据所提交的数据以及专家...
|

|
【更新提示】识林一周回顾(20200511-0517)
2020.05.18
上周国家局继续发布重磅文件,包括化学药品注射剂仿制药质量和疗效一致性评价,药品说明书和标签管理规定修订,药物临床试验适应性设计指导原则等内容;WHO 发布在清洁验证中建立残留限度的不同方法的考虑要点,以识别共用设施生产时的污染风险,以及制药用水 GMP 指南;识林整理了关...
|

|
WHO 共用设施清洁验证残留限度建立方法的考量要点草...
2020.05.18
WHO 于 5 月 14 日发布《在共用设施生产时为识别污染风险而在清洁验证中建立残留限度的不同方法(包括 HBEL)的考量要点》指南草案,如题所述,指南草案讨论了在为使用共用设施生产建立安全残留限度时可采用的不同方法,包括药理学和毒理学数据方法(基于健康的暴露限,HBEL)。
HB...
|

|
【周末杂谈】药品法本身有矛盾怎么办?
2020.05.17
诠释法律条款的原则是,重视结合上下文的整体解读,而非抠字眼。
规章有写得不清楚的地方,FDA可以修订规章,但要走反复公示和征求意见的行政程序。FDA也可发布行业指南,虽不及规章的执行力度大,但来的快。法官还可借助具体诉讼案件,以案例判决书的形式,直接给出具有广泛参照作用的...
|

|
欧洲监管和企业专家联合发文讨论如何改善上市后证据生...
2020.05.16
一份新的学术论文解释了企业如何通过在药物开发过程中合适的时间寻求欧盟监管机构和卫生技术机构的科学建议来改善其上市许可后证据生成计划。
监管机构和卫生技术评价(HTA)机构经常要求药物开发者开展研究用于许可后或上市后证据生成(post-licensing evidence generation, PLEG...
|

|
FDA OTC 大改革:收费,18个月专营权,按新药重新提...
2020.05.15
为应对冠状病毒大流行造成的巨大经济影响,美国《冠状病毒援助、救助和经济安全法案》(简称《CARES法案》)
非处方药不需要凭执业医师或执业助理医师处方,可由患者或消费者自行判断、购买和使用,在人们的日常生活用药中占有很大比例,在医疗体系中扮演着重要角色。
新法使OTC产品...
|

|
WHO 修订制药用水 GMP 指南草案
2020.05.15
世界卫生组织(WHO)于 5 月 11 日发布《GMP:制药用水》指南草案,整合了有关注射用水(WFI)相关指南带来的最新变化,
2019 年 10 月,WHO 药物制剂专家委员会(ECSPP)通过了《非蒸馏方式生产注射用水》指南,阐述了其对使用替代生产技术的期望。WHO 在注意到一些药典修订...
|

|
FDA 发布两指南为新冠治疗药研发和临床研究提供具体...
2020.05.14
美国 FDA 5 月 11 日发布了两篇指南,旨在加速开发用于治疗或预防新型冠状病毒疾病(COVID-19)产品的开发,指南为帮助企业顺利进入研究用新药申请(IND)阶段提供了建议,并提供了有关后期研究临床试验设计的考虑。
这两篇新指南在 FDA 于 三月份启动 FDA 冠状病毒治疗加速计划...
|
|
吉利德许可五家仿制药商生产瑞德西韦,产量与覆盖面仍...
2020.05.14
吉利德(Gilead)公司在其瑞德西韦(remdesivir)获得美国 FDA 紧急使用授权(EUA)用于治疗新型冠状疾病(COVID-19)之后,一直在寻找生产合作伙伴以帮助提高产量。5 月 13 日,吉利德宣布已经与五家仿制药生产商达成一系列许可协议,暂免专利费。
吉利德与在印度和巴基斯坦运营...
|

|
欧盟大数据工作组十项实用建议,数据保护问答指南正在...
2020.05.13
欧盟大数据工作组正在研究如何最佳地利用大数据来支持创新和公共卫生,并就可在当前法律框架内实施的工作提供了 10 项优先建议。其中最具雄心的一项提案是将欧盟内部的各种真实世界数据库集成在一个单一安全网络下。
这些建议是由欧洲药品管理局(EMA)和欧盟药品机构(HMA)共同制定的...
|
|
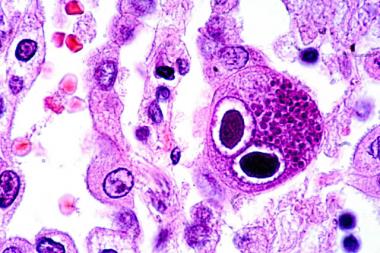
FDA 肝移植中的巨细胞病毒治疗或预防性药物研发指南
2020.05.13
美国 FDA 于 5 月 7 日发布《肝移植中的巨细胞病毒:治疗或预防性药物研发》定稿指南。这份 31 页的定稿指南为寻求开发用于治疗或预防移植患者 CMV 感染药物的制药商提供了 FDA 从早期开发到 3 期有效性试验的建议。
巨细胞病毒(CMV)是一种常见β疱疹病毒,该病毒在全...
|

|
关于供应商管理与监督的几点专家建议
2020.05.12
风险评估、审计以及上市许可持有人与供应商之间的良好沟通是供应商监督的关键要素
在生物/制药行业中,维持安全的供应链至关重要。药品中使用的物料的有效性和安全性至关重要。上市许可持有人/制药企业(下统一称“持有人”)有责任确保其产品中使用的所有物料的质量。持有人对供应链...
|

|
【前沿】机械手操作的全组织培养胃肠道新模型加快口服...
2020.05.12
麻省理工学院(MIT)和哈佛医学院布莱根妇女医院的研究人员设计了一种方法,可以通过快速检测新药在小肠中的吸收程度来加快新药开发。这种方法也可以用于寻找新方法来改善现有药物的吸收,以便可以口服给药。
研究于 4 月 27 日发表《自然·生物医学工程》杂志上,题目为“Robotically h...
|

|
【更新提示】识林一周回顾(20200504-0510)
2020.05.11
上周药审中心发布关于化学药物中亚硝胺类杂质研究的重要指导原则,以及药物临床试验数据递交指导原则;识林新增四篇案例研究,并发布关于 WHO 药品良好贮存和发运指南的中文翻译;FDA 撤销六十多家中国口罩商的出口资格,紧急使用授权首个家庭唾液样本采集检测产品,发布三封警告信( ...
|