
|
FDA 谈制定和实施窄治疗指数药物的标准
2024.02.28
所有药物都有治疗窗,即,提供有效治疗并避免严重不良反应(或副作用)的剂量范围。高于治疗窗的剂量会产生严重的副作用,低于治疗窗的剂量可能是无效的。大多数药物具有较宽的治疗窗,但少数药物 — 窄治疗指数(NTI)药物,治疗窗较窄,需要更仔细地考虑以确定其最佳剂量。
FDA 药...
|

|
FDA 首次动用新程序撤销加速批准
2024.02.27
美国 FDA 于 2 月 23 日发布最终决定撤销 Oncopeptides 公司 Pepaxto(美法仑氟苯酰胺)的加速批准,这是 FDA 首次行使更快撤回未兑现承诺的药物的新权力。
FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 在撤销 Pepaxto 提案的最终决定信中表示,撤销 Pepaxto...
|

|
ICH 计划制定细胞和基因疗法以及真实世界数据相关指...
2024.02.27
2 月 22 日在 ICH 区域会议上,加拿大卫生部和制药行业官员讨论了制定有关细胞和基因治疗以及使用真实世界数据(RWD)进行药物流行病学研究设计来评估新药的协调指南文件。
基因泰克(Genentech)细胞和基因疗法全球主管 Kathleen Francissen 和加拿大卫生部上市医药产品部门负责人 Me...
|

|
IPEM 课程 变更、偏差、CAPA 与风险管理;无菌保证...
2024.02.26
以下文章来源于IPEM ,作者IPEM
变更、偏差、纠正与预防(CAPA)是药品研发和生产企业质量风险管理所必须面对的挑战,是药品研发、技术转移、商业化生产、以至产品退市全生命周期各个阶段质量管理的一个关键环节,也是国际合规检查中的一个重点和主要缺陷存在的薄弱环节。
教师...
|

|
FDA 明确表示不会对未遵守临床试验报告要求的申办人...
2024.02.26
美国 FDA 表示,临床试验申办人未能向政府正确报告试验信息时,不会对其处以罚款或采取更严厉的执法行动。根据 FDA 对一份公民请愿书的回复显示,FDA 表示将继续敦促自愿遵守。
基本药物大学联盟 (Universities Allied for Essential Medicines)去年 2 月份提交的长达 30 ...
|

|
国内药政每周导读:NMPA 行政处罚裁量,CDE 新药转...
2024.02.26
【创新药与临床开发】
2.22,【CDE】关于公开征求《胃食管反流病治疗药物临床试验技术指导原则》意见的通知
2.23,【CDE】关于发布《罕见病酶替代疗法药物非临床研究指导原则(试行)》的通告(2024年第17号)
【CMC与仿制药】
2.18,【CDE】关于公开征求 ICH《Q2(R2)/...
|

|
【周末杂谈】仿制药驱动创新药?
2024.02.25
从数字上看美国药业计划经济和市场经济的怪相
没有创新药,自然就不会有仿制药,道理显然。反过来说,是否也对呢?就不那么显然了。
这个月初,美国普享药协会(原来的仿制药协会)发表了纪念美国《仿制药法》发布40周年的白皮书,其中有这样两句话:Generics drive biomedical innova...
|

|
【识林向导招新】分享知识,获取账号,共建识林社区
2024.02.24
Hi,亲爱的识林用户
识林是制药业一站式法规技术学习平台,专注于药品全生命周期的系统性知识,为求知型人才、学习型企业、知识型产业提供知识驱动的工具和服务。
识林向导,来自制药业一线,用识林汲取知识用于实践,也在此分享所学所思,与识林相得益彰,共同建设服务于制药人的知...
|
|
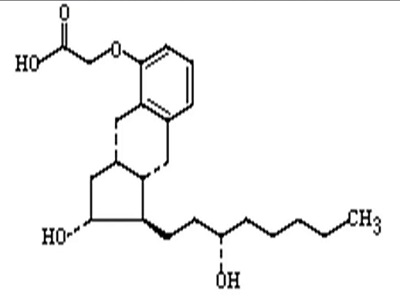
FDA 因对曲前列环素申请的审评程序问题遭到United Th...
2024.02.23
美国生物制药公司 United Therapeutics 于 2 月 20 日向华盛顿特区联邦地区法院提起诉讼,起诉 FDA 错误处理其竞争对手 Liquidia 提交的曲前列环素申请。
曲前列环素是一种治疗肺动脉高压的吸入粉末。United 的财报中显示曲前列环素(商品名为 Tyvaso)在 2023 年的销售额...
|

|
FDA 将对两款 CAR-T 疗法召开专家会,行业聚焦对...
2024.02.23
美国 FDA 将于 3 月 15 日召开肿瘤药物专家委员会(ODAC)全天会议,审查两款用于早期治疗多发性骨髓瘤的 CAR-T 治疗药 —— 百时美施贵宝(BMS)和 2seventy bio 的 Abecma 以及强生和传奇生物的 Carvykti。
届时 FDA 邀请的外部专家将审查 Carvykti 的 CARTITUDE-4 试验和...
|

|
FDA 提醒医疗器械生产商仔细审查第三方实验室数据,...
2024.02.22
美国 FDA 于 2 月 20 日发布了一封给医疗器械行业的信函,提醒医疗器械研究的申办人和生产商在上市前申报数据提交之前仔细审查第三方检测实验室的工作,以防数据造假问题。
FDA 指出,器械公司有责任对生成数据的第三方进行资质认证,并确保提交给 FDA 的所有信息真实准确。
...
|
|
首批帕博利珠单抗生物类似药进入临床试验,默沙东推进...
2024.02.22
根据美国临床数据库 ClinicalTrials.gov,至少有三家公司已经开始或者即将开始 Keytruda(帕博利珠单抗,K 药)生物类似药的试验,预计将为默沙东的重磅抗癌药带来一波更便宜的竞争产品。
这些生物类似药分别由三星 Bioepis、山德士(Sandoz)和 mAbxience Research 开展临床试...
|

|
FDA 发布关于生物制品许可申请和主文件的最终规章
2024.02.21
美国 FDA 于 2 月 12 日发布最终规章以修订法规,解释了申办人如何在生物制品申请(BLA)中使用主文件(向 FDA 提交的包含其生产工艺详细信息的文件)的问题,并对 2019 年的草案版本进行了一些调整,以明确和规范生物制品的申请流程和文件提交要求,提高生物制品审批的效率和质...
|

|
欧洲药典各论亚硝胺杂质新策略
2024.02.21
欧洲药品质量管理局(EDQM)最近发布了有关欧洲药典各论中 N-亚硝胺杂质的策略。这是在去年 11 月由欧洲药典委员会(EPC)批准的。
活性物质方面
EPC 同意从现有的活性物质各论中删除涵盖 N-亚硝胺杂质的生产部分,并在将来新的各论中也不包含此类陈述,因为在修订后的总论(20...
|

|
ICH 发布 E2D 上市后安全性数据指南修订草案
2024.02.20
ICH 于 2 月 12 日发布了新的 E2D(R1)"批准后安全性数据:个例安全性报告管理和报告的定义和标准"指南草案,向公众征询意见。
ICH 于 2003 年 11 月采用了 E2D 的第一个版本;指南旨在建立国际标准化程序,以提高批准后安全信息的质量并统一收集此类信息的方式。但根...
|

|
EMA 发布临床试验中非劣效性比较和等效性比较指南的...
2024.02.20
欧洲药品管理局(EMA)于 2 月 16 日发布了关于临床试验中非劣效性比较和等效性比较指南的概念文件,准备对其已有二十年历史的指南进行修订。
与阳性比较药物的非劣效性比较经常用于药物开发,尤其是在 3 期试验中,旨在为上市许可申请提供关键证据。与非劣效性和治疗等效性比较...
|

|
国际药政每周概要:欧盟发布多个工作组三年工作计划,...
2024.02.20
【监管综合】
【注册、审评、审批】
02.16【FDA】准予 liucel 加速批准以治疗不可切除或转移性黑色素瘤
02.16【FDA】批准首个治疗不可切除或转移性黑色素瘤的细胞疗法
02.12【ICH】E2D(R1) 批准后安全性数据:个例安全性报告管理和报告的定义和标准
02.12【F...
|

|
FDA 批准首个实体瘤个体化 T 细胞疗法
2024.02.19
美国 FDA 于 2 月 16 日加速批准了 Iovance 生物治疗公司的 liucel(Amtagvi),一种肿瘤源性自体 T 细胞免疫疗法,用于治疗先前接受过 PD-1 阻断抗体治疗的不可切除或转移性黑色素瘤成年患者,。
该药是第一个进入市场的个体化肿瘤浸润淋巴细胞(TIL)疗法。这标志着...
|

|
FDA 发布62篇BE指南,多篇指南增加了替代体内BE方案...
2024.02.19
美国 FDA 于 2 月 15 日发布了新一批 62 篇具体产品指南(PSG),为开发仿制药和生成证据以支持简化新药申请(ANDA)批准提供建议,从而帮助简化仿制药的开发和 ANDA 审评,促进仿制药竞争。
这一批具体产品指南包括29 篇新增和 33 篇修订。50 篇(其中 27 篇关于复杂产品...
|

|
【周末杂谈】监管规章和指南
2024.02.18
从制定规章和指南时的一些做法和考虑,看FDA如何维护公信力
十多年前,在一次给国家局药品审评师们办的培训课上,曾任美国FDA医学审评师的李自力博士讲过这样一个故事。FDA在培训自己的新审评师时,提过一个假想的问题:‘科学性和公平性对药品审批来说是最重要的两项原则。若是一定要...
|