|
Moderna 新冠疫苗日本批次发现金属颗粒污染
2021.08.31
美国 Moderna 公司于 8 月 25 日表示正在调查一批发往日本的 mRNA 疫苗,该批疫苗可能受到污染。
Maderna 公司表示收到了“几起关于疫苗小瓶中的颗粒物的投诉。”投诉来自在日本销售的“一批产品”。日本共同社报道称,Moderna 在日本的疫苗合作伙伴武田(Takeda)已暂停使用发...
|

|
【一周回顾】2021.08.23-08.29
2021.08.30
药审中心发布创新药人体生物利用度和生物等效性研究技术指导原则。FDA 正式批准辉瑞和 BioNTech 的 mRNA 新冠疫苗。FDA 发布蛋白原液生产企业监督检查合规计划,发布基于药代动力学的支持 PD-1 或 PD-L1 阻断抗体替代给药方案用于治疗癌症患者的标准。英国MHRA召回一批含亚...
|
|
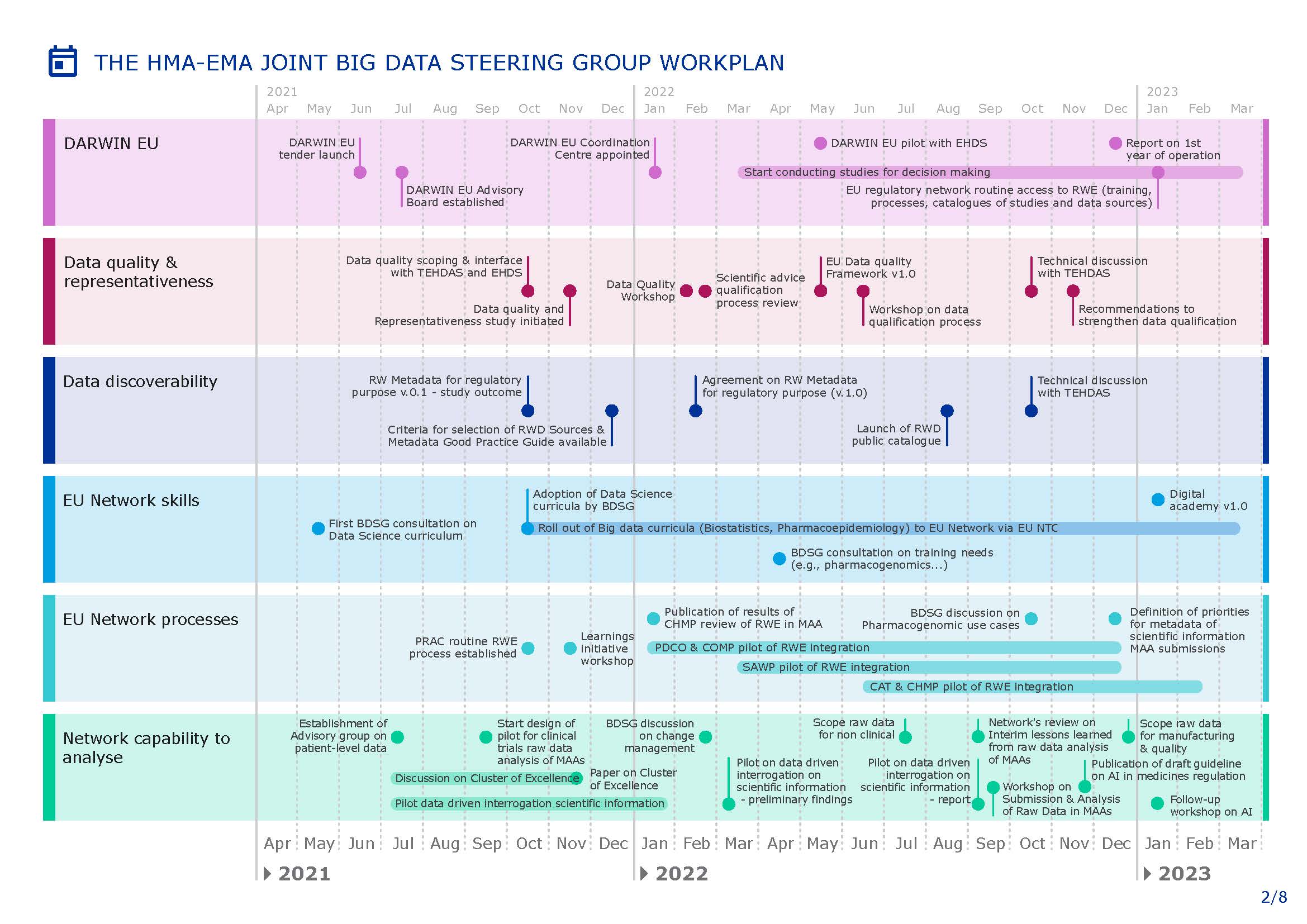
欧盟发布 2021-2023 年大数据工作计划
2021.08.30
欧洲药品管理局(EMA)和欧盟药品机构(HMA)的联合指导小组最近发布了其旷日持久的大数据工作计划的更新,以解决与医疗卫生和药品开发中的大数据相关的问题。
根据 EMA 的大数据网页,指导小组于 6 月通过并于 8 月 27 日发布了 2021-2023 年工作计划,“旨在从数据质量到...
|

|
【质量对话】请加一条缺陷项吧,拜托了
2021.08.29
从质量总监对FDA检查483缺陷信的态度,看企业和监管文化
刺槐:最近在整理往日记录时,发现了一则有趣的GMP现场检查的故事,从一些方面体现了企业的文化。与你分享一下,听听你的看法?
编辑:好啊。
刺槐:2006年时任国际药物工程协会(ISPE)主席、美国强生公司全球药政执行总监的P...
|
|
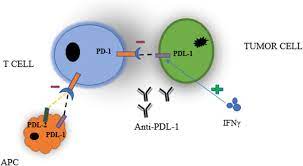
FDA 发布 PD-1 和 PD-L1 癌症免疫疗法替代给药...
2021.08.28
美国 FDA 于 8 月 25 日发布《支持 PD-1 或 PD-L1 阻断抗体用于治疗癌症患者的替代给药方案的基于药代动力学的标准》指南草案,用于帮助申办人“寻求与临床疗效和安全性试验中测试的不同的替代静脉注射(IV)给药方案的批准”。
程序性细胞死亡受体-1(PD-1)和程序性细胞死亡...
|

|
FDA 明确表示尚无恢复国外现场检查的计划
2021.08.27
美国 FDA 表示目前没有计划恢复对在新冠(COVID-19)公共卫生紧急情况期间不被视为“关键任务”的操作进行国外现场检查。相反,FDA 继续依赖扩大使用互认协议作为现场检查的替代工具。
FDA 监管事务办公室(ORA)药品质量运营总监 Alonza Cruse 在 8 月 25 日药品审评与研究中...
|

|
FDA 就微粒污染和数据可靠性问题向一日本企业发出警...
2021.08.27
近年来,微粒污染问题一直是许多制药企业的绊脚石,日本药企东洋纺(Toyobo)就因为此问题以及数据可靠性问题于 8 月 19 日收到美国 FDA 的警告信。
FDA 在警告信中指出东洋纺未能确定某些药物中微粒污染物的来源,并且没有对数据可靠性违规进行调查。FDA 于今年 2 月 15 日至...
|

|
FDA 疫情期间对印度公司的检查情况如何?
2021.08.26
美国 FDA 现场检查时间表的不确定性是印度药企第一季度财报会上反复讨论的话题。从 2021 年 2 月到 2021 年 8 月,FDA 在印度进行了七次药品检查。我们通过一些印度企业的财报电话会看看当前检查的开展情况以及印度药企对检查的期待。
FDA 表示,鉴于疫情的不确定性,FDA ...
|

|
专家提出改革 FDA 加速审批路径的 10 项措施
2021.08.26
美国 FDA 加速审批计划已经实施超过 25 年,随着各方的质疑,这一路径似乎已经到了面临选择的十字路口。
大约一年前,FDA 肿瘤卓越中心启动了对抗癌药加速审批的审查。【FDA 正广泛审查加速审批程序,已撤销四个癌症适应症 2021/03/12】;【从三天 PD-1 L1 专家会看加速审...
|

|
FDA 探索连续制造过程对治疗性蛋白质病毒安全性的影...
2021.08.25
连续制造是业界发展趋势,但对蛋白质药物来说仍是新概念,今年 7 月份 ICH 发布的 Q13《原料药与制剂的连续制造》指南中专门有一个附件来介绍治疗性蛋白原液的连续制造【连续制造之治疗性蛋白原液】。美国 FDA 最近在介绍其监管科学行动的“影响力故事”专栏中介绍了药品审评与研究中心...
|

|
FDA 处方药使用者付费重新授权将承诺扩大实时审评
2021.08.25
美国 FDA 于 8 月 23 日发布了处方药使用者收费重新授权(PDUFA VII)承诺函,PDUFA VII 的实施时间为 2023-2027 年。FDA 和行业代表在承诺函中同意创建“分步实时申请审评(STAR)”试点计划,该计划仅可用于满足以下四个标准的所有治疗领域的有效性补充申请:
“来自充...
|
|
加速批准艰难撤销:FDA 将举行听证审查有争议的早产...
2021.08.24
根据 8 月 19 日 Covis 公司的新闻稿,美国 FDA 将举行听证会,讨论 Covis 是否应在一项关键研究发现药物无效后自愿撤销其早产预防药 Makena(17 α-己酸羟孕酮,又称 17P)。
两年前,FDA 专家顾问委员会建议在确证性试验未能证实临床获益后撤回 Makena。97 的投票结...
|

|
辉瑞新冠疫苗获 FDA 正式批准用于 16 岁以上人群
2021.08.24
美国 FDA 于本周一(8 月 23 日)宣布正式批准辉瑞和 BioNTech 的 mRNA 新冠(COVID-19)疫苗用于 16 岁及以上的个人,成为首个获得完全批准的新冠疫苗。
该疫苗之前于 2020 年 12 月 10 日获得 FDA 针对 16 岁以上人群的紧急使用授权(EUA)【辉瑞新冠疫苗专家会意...
|

|
【一周回顾】2021.08.16-08.22
2021.08.23
美国 FDA 发布 2020 财年药品质量状况报告,发布以药代动力学为终点评价指标的 ANDA 提交的药物生物等效性研究指南,发布 23 篇新增和 16 篇修订 BE 指南。药审中心发布多篇技术指导原则。识林新增从监管角度对临床试验中常见统计学专业问题的探讨、药品研制现场核查要点分...
|

|
FDA 发布 39 篇 BE 指南,新增复杂鼻喷雾和索马鲁...
2021.08.23
美国 FDA 于 8 月 20 日发布了新一批 39 篇具体产品指南(PSG),为仿制药的开发和生成支持简化新药申请(ANDA)批准所需的证据提供建议,从而帮助简化企业仿制药开发和 FDA 的 ANDA 审评。
这一批 39 篇具体产品指南包括:23 篇新增和 16 篇修订。28 篇(其中 15 ...
|

|
【周末杂谈】标签与监管 — 创新与仿制之争
2021.08.22
从法院的判决,看药监法规与专利保护间的关系,及仿制与创新间的平衡
美国联邦上诉法院8月5日的一项关于仿制药“标签剔除(label carve-out)”或称“缩减标签(skinny label)”的裁决,为了解药监法规与专利保护间的关系、仿制与创新间的平衡、意图和结果的法律意义等,提供了难得...
|

|
FDA 发布药代动力学终点的仿制药 BE 研究修订指南
2021.08.21
美国 FDA 于 8 月 20 日发布了《ANDA 提交的药物以药代动力学为终点评价指标的生物等效性研究》修订指南草案。指南为计划提交简化新药申请(ANDA)的申请人提供了建议。
指南包括有关如何满足《联邦食品、药品和化妆品法案》(FDCA)和 FDA 法规中规定的 BE 要求的建议。指...
|

|
制药行业协会联名敦促 PICS 更好地研究和分享虚拟检...
2021.08.20
随着国际药品检查认证合作组织(PIC/S)正在制定未来五年的战略重点,制药行业建议分享虚拟检查经验,并阐明各种检查工具如何有效协同工作。
尽管与新冠(COVID-19)疫情相关的旅行限制迫使许多监管机构探索虚拟检查以检查药品生产场所的持续合规性,但人们普遍认为,即使在疫情结束...
|

|
真实世界证据研究中可能出问题的地方有哪些
2021.08.20
在监管决策中增加真实世界证据的使用一直是美国 FDA 和行业的热点问题。但陷阱也不少,包括我们前天报道的关于【研究显示抗癌药真实世界研究质量不佳】的资讯。
全球信息和技术医疗服务提供商 IQVIA 真实世界解决方案首席科学官 Nancy Dreyer 在 6 月份举办的 DIA 年会上指...
|

|
【全文翻译】FDA 2020 财年药品质量状况报告
2021.08.19
美国 FDA 药品质量办公室(OPQ)于 8 月 17 日发布 2020 财年《药品质量状况》报告,这是 OPQ 连续第三年发布这一报告,“报告总结制药行业向美国患者和消费者提供优质药品能力的关键指标”。识林对报告内容做了全文翻译,供大家阅览。
FDA 在报告中指出,“我们在此报告...
|