
|
英国 MHRA 总结临床试验中电子病例报告表的常见情形...
2021.05.12
随着在临床试验中采用电子工作方式并将更多电子系统集成在一起,英国 MHRA 的 GCP 检查员注意到,并非所有的电子系统的设计都考虑到了正确的功能。这是因为其中一些系统有可以向申办人报告方案所要求的临床数据的机制,从而可以充当电子病例报告表(eCRF),但相比于满足 ICH GCP ...
|

|
礼来爆出内部员工投诉高管造假、FDA 最新检查缺陷等...
2021.05.11
根据路透社 5 月 5 日报道,礼来公司内部的一份投诉显示,其员工控告新泽西州 Branchburg 礼来工厂(该厂主要生产新冠治疗性抗体)的一名高管修改 FDA 要求的文件以试图淡化严重的质量控制问题。
这份未签字的投诉报告于 4 月 8 日在礼来保密的员工投诉系统中提交。投诉称,该高...
|
|
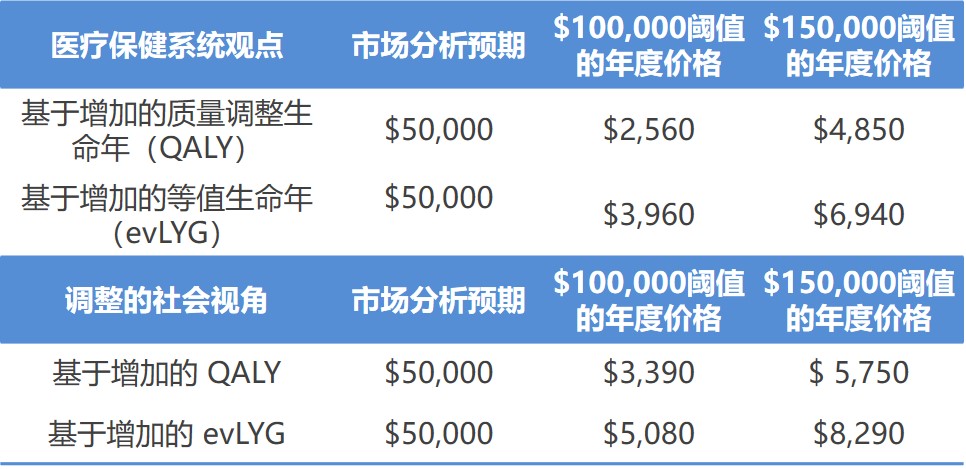
ICER 公布渤健阿尔茨海默治疗药成本效益定价,远低于...
2021.05.11
美国临床与经济评价研究所(ICER)在 5 月 5 日发布的一份草案报告中表示,渤健(Biogen)备受瞩目的阿尔茨海默症治疗药 aducanumab,由于获益证据“不足”,该药的成本应低至每年 2500 美元才被认为具有成本效益。
即使采用较高的成本效益阈值,ICER 的估计价格为 8,290 美...
|

|
【一周回顾】2021.05.03-05.09
2021.05.10
国药中生北京公司新冠灭活疫苗列入 WHO 紧急使用清单。国家局发布关于适用 ICH M9 和 Q5D 指南的公告。识林报告三四月美国和欧盟药品批准和补充申请情况;识林发布药品注册管理办法配套文件梳理思维导图。美国宣布支持放弃新冠疫苗专利;FDA 发布检查监督弹性路线图。
上周热...
|

|
【周末杂谈】FDA 监管信息化的小插曲
2021.05.09
有百利而无一害的药品说明书信息化,就是行不通
药品有标签和说明书。简要疗效和使用说明印在药盒的标签上。详细的有效性、安全性、临床证据、用法用量、禁忌、分子结构和成分等,写在药盒中折起来的说明书上。说明书长短不一,据美国FDA统计,从几页纸到45页纸不等。当然,这要看纸有...
|

|
国药新冠疫苗列入WHO紧急使用清单,辉瑞申报新冠疫苗...
2021.05.08
国内时间 5 月 7 日晚 11 点,世界卫生组织(WHO)总干事谭德赛宣布,中国国药集团中国生物北京生物制品研究所研发的新冠灭活疫苗通过技术审评,被列入紧急使用清单(EUL)。谭德赛表示,这是 WHO 认证的第六款安全有效的高质量疫苗,其它五款疫苗分别是来自辉瑞-BioNTech、阿斯...
|
|
美国支持放弃新冠疫苗专利就一切顺利了吗?斗争刚刚开...
2021.05.07
美国政府于 5 月 5 日宣布支持世界贸易组织(WTO)放弃对新冠疫苗知识产权的保护,但这只是复杂过程中的第一步,制药商在之后的过程仍会以对自己有利的方式进行抗争。在免除专利以及任何人都可以使用知识产权来生产仿制新冠疫苗之前,仍然有一些步骤,而制药商在这些步骤中可能会采取...
|

|
FDA 检查监督弹性路线图,疫情下检查延期致 48 件...
2021.05.07
美国 FDA 于 5 月 5 日发布《FDA 检查监督弹性路线图》,介绍了检查积压的增长以及对批准和合规性后续措施的影响,并给出了三种不同情形下的检查进展预期。
FDA 在报告中指出,由于疫情期间难以检查或评价生产设施,而导致有关人用药的 48 件审评决定被推迟,其中包括 6 件...
|

|
识林招聘 2021
2021.05.07
识林致力于导向知识型产业、学习型企业、求知型人才的行业进步,欢迎志向相同者加盟,共创理想明天,你若:
渴望成为领跑者,而非跟随者,更非落伍者;
走向有作品显示度、有职业经验竞争壁垒的一席之地而非容易替换的标准件;
喜欢从事“信息 →知识 →工具”的创意型工作;
善...
|
|
FDA 仿制药综合生产评价、无菌保证以及上市后药物警...
2021.05.06
今天我们来看看美国 FDA 2021 仿制药论坛上有关生物药剂学风险评价、综合生产评价(integrated manufacturing assessment)、无菌保证以及仿制药上市后药物警戒方面的讨论。
药品质量办公室(OPQ)生物药剂学处代理生物药剂学主管 Min Li 讨论了生物药剂学风险评价用于指导固...
|

|
英国生物类似药简化许可路径,或成全球监管新趋势
2021.05.06
英国药品与医疗保健产品监管机构(MHRA)提出了针对生物类似药的简化许可途径,使得英国有望成为生物类似药监管中的世界领先者。
MHRA 于去年制定了生物类似药简化许可途径的计划,该计划通常不要求比对有效性数据,并且会考虑已批准的生物类似药与参照产品对于所有适应症的互换。这一...
|

|
仿制药申报前如何与 FDA 沟通?如何避免被拒收?
2021.05.05
美国FDA 2021 仿制药论坛 4 月 28 日下午的报告信息量充足,为成功完成简化新药申请(ANDA)申报和批准提供了大量审评信息和建议。昨日我们介绍了仿制药论坛上介绍的政策和工作重点:【FDA 2021 仿制药论坛上总结的政策和工作重点】。识林已收录“2021 仿制药论坛 — 仿制药的...
|

|
百时美施贵宝新 CAR-T 工厂将实现自动化和虚拟现实...
2021.05.05
随着越来越多细胞疗法的涌现,如何快速可靠地制造个体化药物成为现实问题。百时美施贵宝(BMS)对新建的两个细胞疗法工厂正在实现自动化和高科技培训。
BMS 最近获批的 CAR-T 药品 Breyanzi 和 Abecma 都是高度个体化的生产过程:使用血液成分置换程序直接从患者体内收集 T ...
|

|
FDA 2021 仿制药论坛上总结的政策和工作重点
2021.05.04
美国 FDA 一年一度的仿制药论坛于 4 月 28 至 29 日召开,会上讨论了很多重要话题。今天我们先来看看整体有关仿制药审评和政策方面的内容。
首先仿制药办公室(OGD)主任 Sally Choe 做了有关 OGD 整体工作的报告。Choe 指出,为满足与新冠大流行相关的需求,OGD 在 2021 ...
|
|
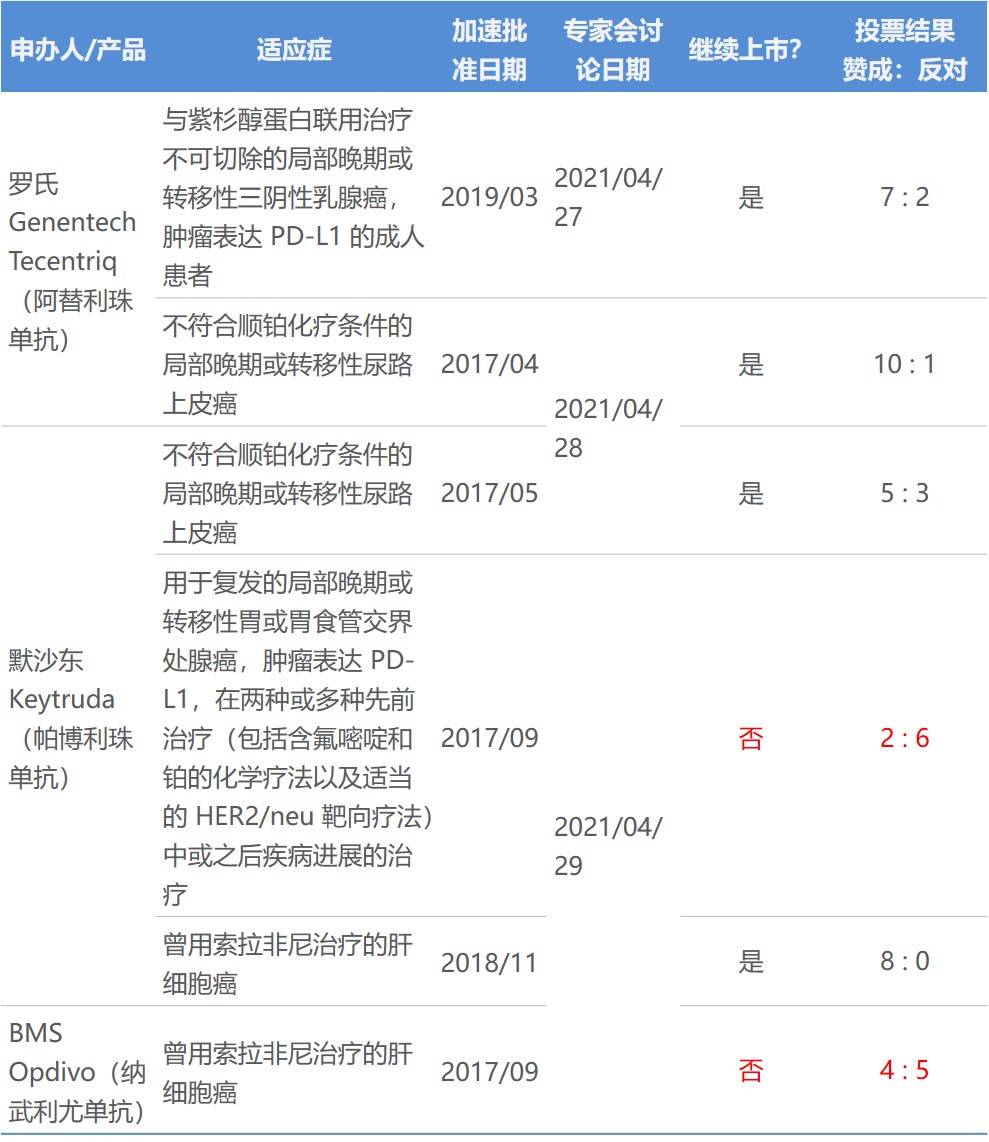
从三天 PD-1 L1 专家会看加速审批未来和专家与监...
2021.05.04
美国 FDA 对三个 PD-1/L1 药物的六个加速审批适应症持续三天的专家会审已经结束,尽管肿瘤药咨询委员会(ODAC)的投票表明某些检查点抑制剂的适应症可能很快会从产品标签中删除,但加速审批监管途径本身的地位并未受到威胁。
PD-1/L1 抑制剂的申办人在 4 月 27 日至 29 ...
|

|
【一周回顾】2021.04.26-05.02
2021.05.03
药审中心公开 ICH 指导原则实施情况宣讲会视频。PIC/S 发布更新的 GMP 指南,修订附录2,增加先进治疗产品的生产指南。美国 FDA 首次对未公开临床试验信息的企业采取罚款措施;发布个体化反义寡核苷酸治疗药物的非临床检测指南。WHO 发布监管决策中的良好信任实践和医疗产品良...
|

|
WHO 定稿良好监管实践和信赖指南,促进各国建立强有...
2021.05.03
世界卫生组织(WHO)最近发布了两份文件,对于加强各国监管体系活动至关重要,包括监管合作、趋同和透明度。
WHO 第 55 届药物制剂规范专家委员会(ECSPP)技术报告 1033(TRS 1033)中以附件 10 和 附件 11 的形式发布了有关良好监管实践(Good Regulatory Practices, GRP...
|

|
【周末杂谈】利益关系面前,谁也无能为力
2021.05.02
在临床试验信息公开事情上,看FDA是如何裹足不前的
2004年9月30日,美国默克公司畅销止痛药万络(Vioxx),因严重不良反应主动撤市,当天公司股票下跌27%,市值损失250亿美元。最终,因法律官司,公司赔付患者49亿美元、股东8.3亿美元,并被政府罚款9.5亿美元。这些都是众人皆知的事...
|

|
众监管机构讨论远程虚拟检查的期望和挑战,迫切希望回...
2021.05.01
美国 FDA 和欧洲药品管理局(EMA)的监管者们于 4 月 28 日在 ISPE 全球制药监管峰会上提供了有关桌面检查和虚拟检查的最新信息,并就如何确保更顺畅的检查提供了建议。
尽管监管机构似乎已经接受了在疫情期间执行虚拟检查和桌面检查的现实,但会上大量监管官员表示,现场检查更容...
|

|
PD-1 L1专家审查第二天:K药和T药膀胱癌适应症前景...
2021.04.30
美国 FDA 肿瘤药专家咨询委员会(ODAC)两个不同的专家小组于 4 月 28 日讨论了默沙东Keytruda(帕博利珠单抗,K药)和Genentech 的 Tecentriq(阿替利珠单抗,T药)各自关于膀胱癌适应症的加速批准。两个药尽管免疫疗法和适应症相似,但专家投票数却大不相同。
专家投票结果:...
|