|
FDA 2019 财年药品检查观察项和趋势
2019.12.19
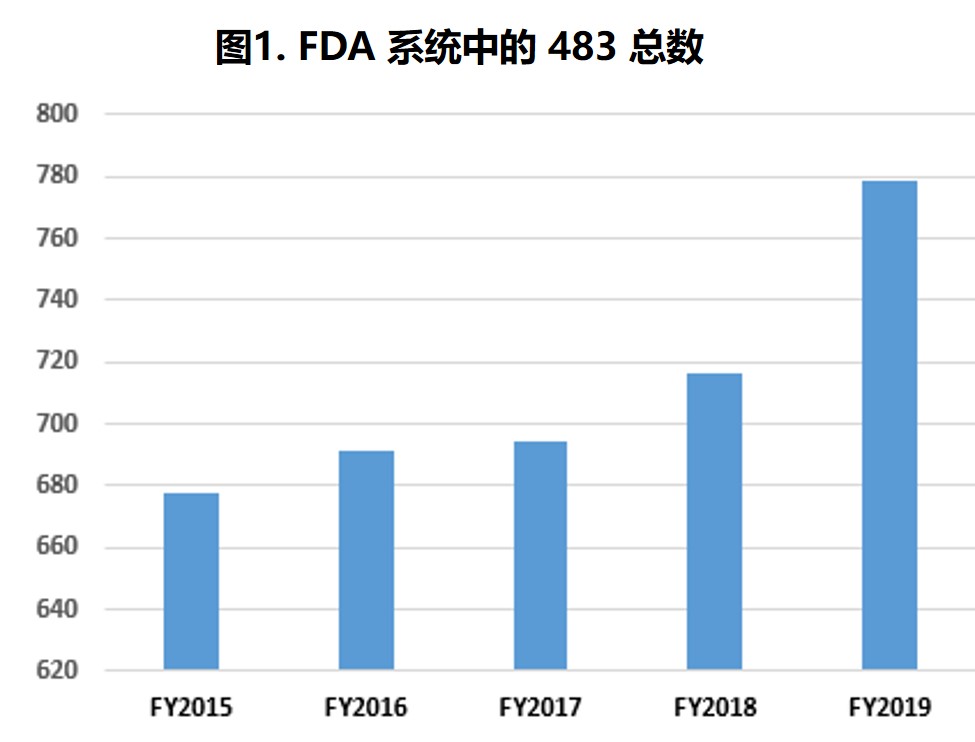
过去五个财年中,分析中所包含的 483 数量每年都略有增加,检查次数在 645 到 779 次之间(表1第2行和图1)。
自 2013 财年以来,指证 §211.192(偏差调查)失败的观察项在 2018 财年首次从名单魁首的位置上移下来。
2018 财年,§211.160(b)(实验室控制应包括科学合...
|

|
无菌药品检查国际合作试点启动,中国和印度或将面临更...
2019.12.19
欧洲药品管理局(EMA)于 12 月 17 日宣布启动一项为期两年的无菌药品 GMP 检查国际合作试点计划,该计划可以使包括欧盟、美国、英国、澳大利亚、加拿大、日本等国在内的监管机构共享无菌药品生产场地的 GMP 检查信息。参与机构由此而节约的检查资源或将更多的集中在高风险场地和...
|
|
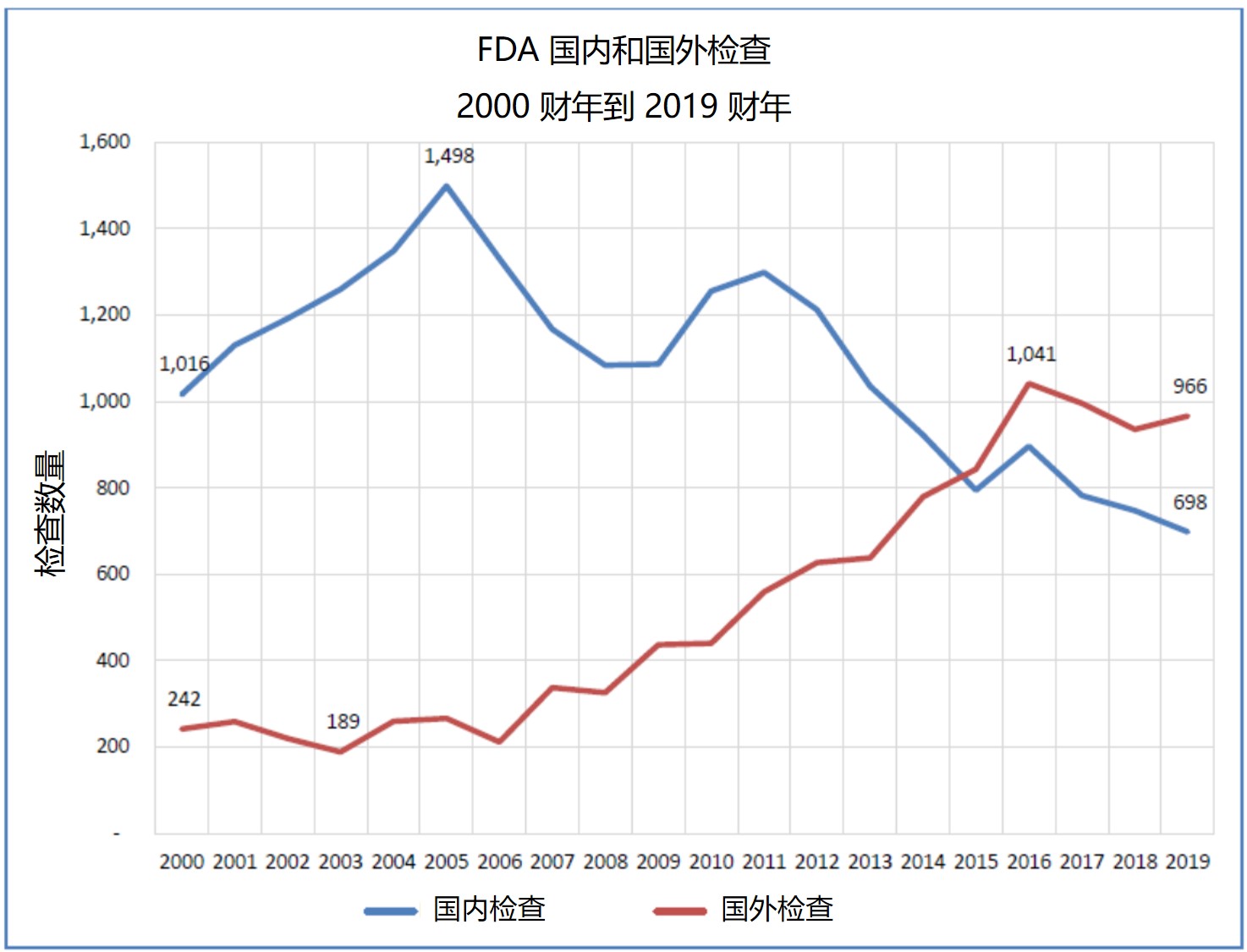
FDA 药品中心主任表示国外检查需要更多检查员和翻译...
2019.12.12
美国 FDA 药品审评与研究中心(CDER)主任在 12 月 10 日举行的众议院能源与商业监督小组委员会关于“保护美国药品供应链:监督 FDA 国外检查计划”听证会上表示,如果国会批准,FDA 可以使用更多资源执行更多国外检查。听证会上,Woodcock还为有关 FDA 严重依赖国外提前通知的...
|

|
识林助力海南药业国际化
2019.11.09
2019年11月7日,海南省医药行业协会、和识林联合举办“海南医药行业国际化认证标准培训”, 200余名药企代表参加了会议。
海南省医药行业协会会长陈益智、副会长李伟、秘书长鲁红出席会议,培训开班仪式由海南省医药行业协会轮值常务副会长仲盛祥主持,培训会由海南省药品监督管理局药...
|
|
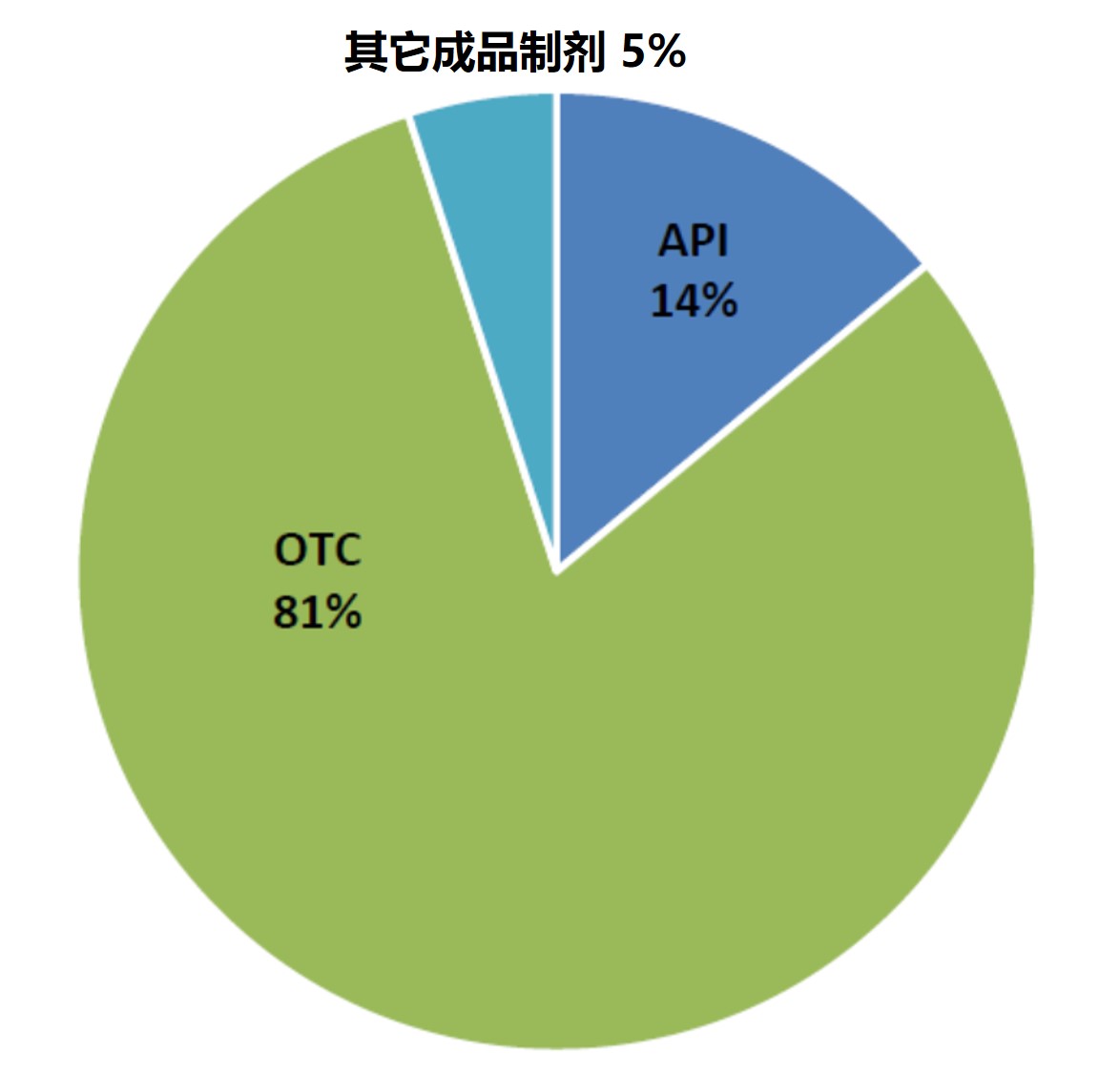
FDA 从未检查过的生产场地中四分之一 GMP 不合规
2019.11.08
我们在昨天的资讯中介绍了从 2015 财年到 2019 财年,FDA 发出的与生产质量相关的警告信数量激增,从 2015 财年的 19封到 2019 财年的98 封,昨日我们介绍了这些警告信的去向以及警告信周转时间缩短【FDA 警告信数量增加时间缩短,原料药商应注意三大趋势】。今天我们来看看导...
|

|
FDA 谈产量实时监管, 及海外检查等问题
2019.11.04
随着美国药品和原料药的生产向海外转移以削减成本,质量和可靠性问题日益凸显,美国众议院能源与贸易委员会卫生小组委员会于 10 月 30 日召开主题为“保护全球经济中的药品供应链”听证会,就药品供应链问题聆讯来自 FDA 和其他相关部门的领导者。FDA 药品审评与研究中心(CDER)主任 Ja...
|

|
FDA 新检查方案项目扩展至非无菌药,使用质量成熟度...
2019.10.04
美国 FDA 宣布计划于明年将新检查方案项目(NIPP)扩展到非无菌药物,并简要介绍了 FDA 在检查过程中用于衡量药品质量的指标。
FDA 官员于 9 月 17-18 日在华盛顿举行的 PDA/FDA 联席监管会议上向业界简要介绍了 NIPP 项目,并表示,检查人员正在使用 St.Gallen 大学...
|

|
FDA 总结 2019 财年警告信四大趋势
2019.09.24
美国 FDA 生产质量办公室副主任 Rick Friedman 于 9 月 16 日在华盛顿举行的 PDA/FDA 联席监管会议上,对 2019 财年最新 GMP 违规导致的警告信发布情况做了通报,并通过最近一些警告信来举例说明了检查员发现的一些缺陷项。
本财年到目前为止生产质量办公室已发布 89 封...
|
|
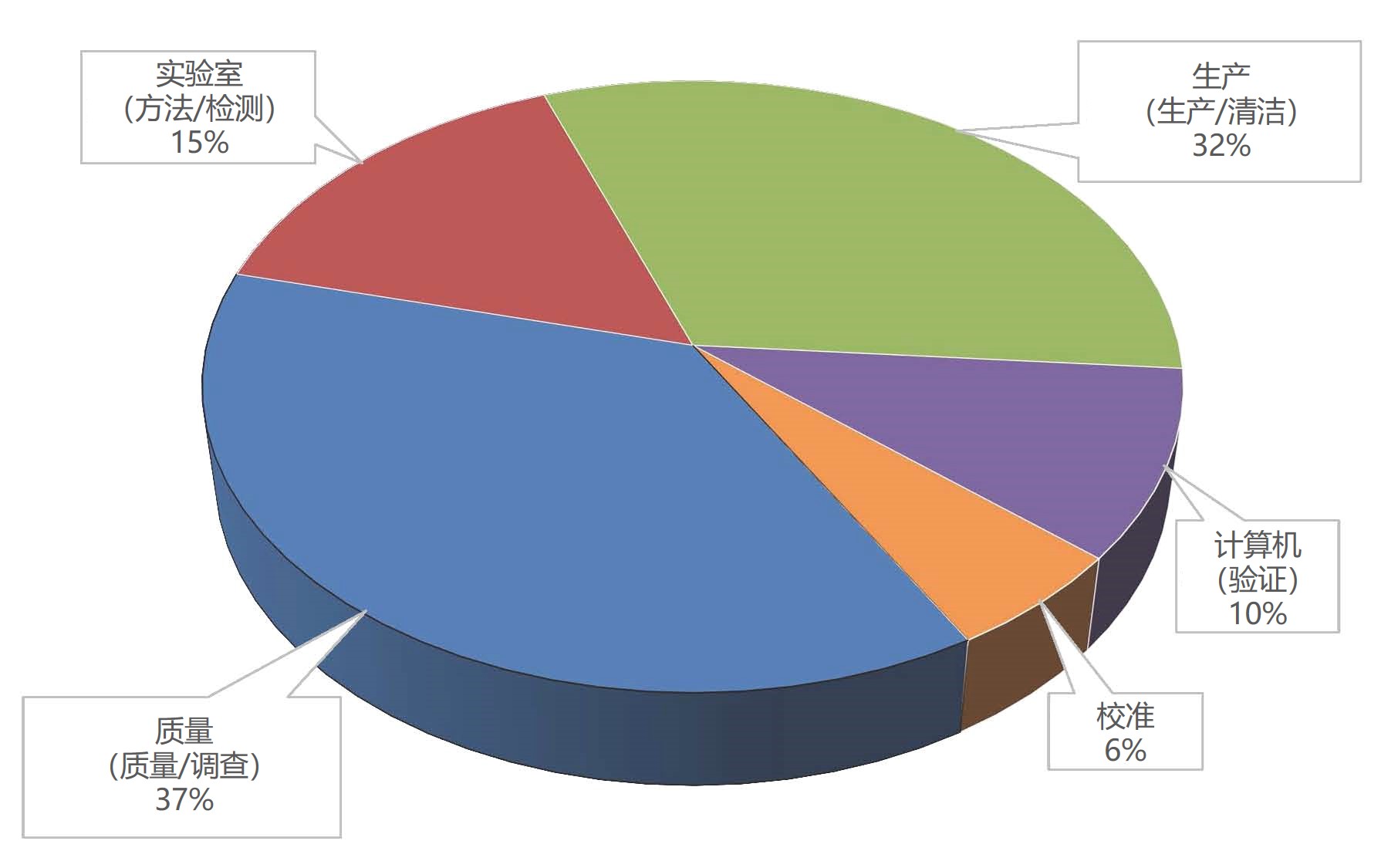
FDA点评2018财年十大引证项,数据可靠性和质量文化仍...
2019.09.20
美国 FDA 监督消费者安全办公室的官员 Dell Moller在今年三月份的 FDA/Xavier PharmaLink 会议上报告了 FDA 2018 财年十大最常见药品 GMP 检查引证项。本文总结了 Moller 幻灯片中 FDA 对各引证项的简要分析,以及 Moller 与 FDA 专家组成员 FDA 药品质量运营办公室(OPQO)3...
|

|
FDA 境外检查数量增加,执法行动比率更高
2019.09.03
昨天我们介绍了“海边 GMP”年会上美国 FDA 对于拥有成熟质量体系的重视【FDA 关于质量体系成熟度十大标志的建议 2019/09/02】,今天我们结合 FDA 发布的检查信息来看看此次会议上报告的 FDA 合规检查情况和一些统计数据。
药品方面
FDA 统计数据显示,尽管 FDA 药品审评...
|

|
FDA 境外飞行检查摆上桌面,直指中国和印度
2019.08.17
美国参议院财政委员会主席共和党议员 Chuck Grassley 于 8 月 6 日在写给美国卫生部部长和 FDA 代理局长的一封信中表示,希望对于国外制药工厂,尤其是中国的工厂,FDA 不再提前通知检查安排而是开展不经提前通知的“飞行检查”。
Grassley 在信中写道,美国药品中使用的原料...
|

|
从教训开始学习 – 看看回复483有哪些常犯的错
2019.08.06
是不是检查结果不好就会收到警告信呢?根据识林483数据库(即将上线,数据库收录了美国FDA 过去十年近50000条检查信息和6000多封483报告原文,还可提供检查员信息等迎检定制服务),官方行动指示(OAI)最终转化为警告信的比例近似为20%(考虑到检查结果的升级和降级,这个比例是假设FDA...
|
|
FDA在废品场发现GMP文件,印度药厂再陷数据可靠性漩涡
2019.07.19
美国公众与监管机构对于在亚洲生产的药品质量一直不能放心,最近一封涉及美国仿制药最大供应商之一 — Strides 药业的警告信再次说明了问题的严重性。
根据 FDA 本周在其网站上发布的 7 月 1 日的一封警告信,FDA 检查员在位于印度 Puducherry 的 Strides 工厂的废品场发...
|

|
欧美检查互认协议完全实施,下一步或扩大共享信息范围
2019.07.13
随着美国 FDA 于 7 月 11 日完成对斯洛伐克国家药品管控研究所的认可,FDA 已经根据 2017 年 3 月与欧盟达成的互认协议(MRA),完成了对所有 28 个欧盟成员国药品检查机构的能力评估。下一步,美国 FDA 和欧盟当局可能很快就会开始考虑如何以及是否共享与印度和中国相关的...
|

|
FDA 因对中国和印度工厂检查不力受到质疑
2019.07.04
由于美国民众持续关注从其它国家进口的药品,以及近期对使用海外原料药生产的降压药的一系列召回的持续担忧,美国众议院和参议院议员要求 FDA 解释其是如何保护药品供应链的。与此同时,众议院的一个两党小组希望美国政府问责办公室(GAO)审查 FDA 的检查计划。
在上周晚些时候发...
|

|
设备没清洗?工人欢度假期去了
2019.06.01
警告信是掌握美国FDA的CGMP合规要求和趋势的重要学习资料,不仅包含制药企业不该触碰的合规“红线”,还警示企业遇到问题不该采用的错误解决思路。但今天我们选出的这封警告信却有着搏君一笑的作用,其中的缺陷项并不独特,但是企业的解释却令人称奇。
这是一封美国 FDA 于 5 月 2...
|

|
WHO 检查机构质量体系要求指南重要更新
2019.05.29
世界卫生组织(WHO)于 5 月 23 日发布《国家检查机构的质量体系要求》工作文件征求意见稿,对已经实施了 17 年的适用于国家 GMP 检查机构的基本质量体系要求进行了重大修订。WHO 建议扩大指南涵盖范围,并使其内容与国家标准和最新的质量管理体系(QMS)原则保持一致。修订后的...
|

|
FDA 药品质量状态报告全文翻译
2019.05.15
美国 FDA 于 5 月 13 日发布了一份关于《药品质量状态》的报告,报告展示了制药行业在向美国提供优质药品能力方面的年度一览。该报告基于可用的 FDA 具体药品和具体生产现场数据的质量指标进行客观评价。FDA 根据地理区域、治疗类别、申请类型和生产领域对生产现场检查数据进行...
|

|
保密特权挑战 GMP 检查员查阅质量文件的权限
2019.05.06
美国食品药品和化妆品法(FDCA)给予 FDA 查阅制药公司 GMP 文件的权力。公司拒绝或阻碍此权利的实施可导致 GMP 违规,其生产的药品可被视为伪劣(adulterated) 产品,从而不被批准或被禁止销售。看似直截了当的事,但竟然有一家公司敢于挑战。去年 8 月,美国 Immunomedics 公...
|

|
欧盟发布 2006-2018 检查和缺陷趋势概况文件
2019.05.03
欧洲药品质量管理局(EDQM)于 4 月 30 日发布《EDQM 检查和缺陷趋势:2006-2018 概况》文件,回顾了 EDQM 在 2006 年至 2018 年间开展的 API 检查数据。文件虽仅有 10 页但干货满满,有各种图表给人以直观感觉,识林对文件全文做了翻译,供大家阅读。
1) 介绍
...
|