
|
【周末杂谈】监管的春天来了?
2021.02.07
美国忽左忽右的监管政策,但愿不会影响到FDA
1月20日,拜登总统就职当天,签署了17项总统政令。媒体的报道集中在新冠防治、经济救济、环保和移民政策等社会广泛关注的政令上。对药业可能有重要影响的,则是未引起普遍注意的一项名为 “监管审查现代化”(Modernizing Regulatory Revi...
|
|
FDA 将制定新指南并召开疫苗专家会应对新冠病毒变种
2021.02.06
新冠(COVID-19)病毒变种促使新冠疫苗生产商开始开发现有产品的更新。为加快这一开发过程,美国 FDA 表示正在制定有关针对变种病毒的更新疫苗的加快审评规则。
FDA 在决定是否因 SARS-CoV-2 病毒的新变种而要求新冠治疗药或疫苗更新紧急使用授权(EUA)时将考虑多个因素,包括...
|
|
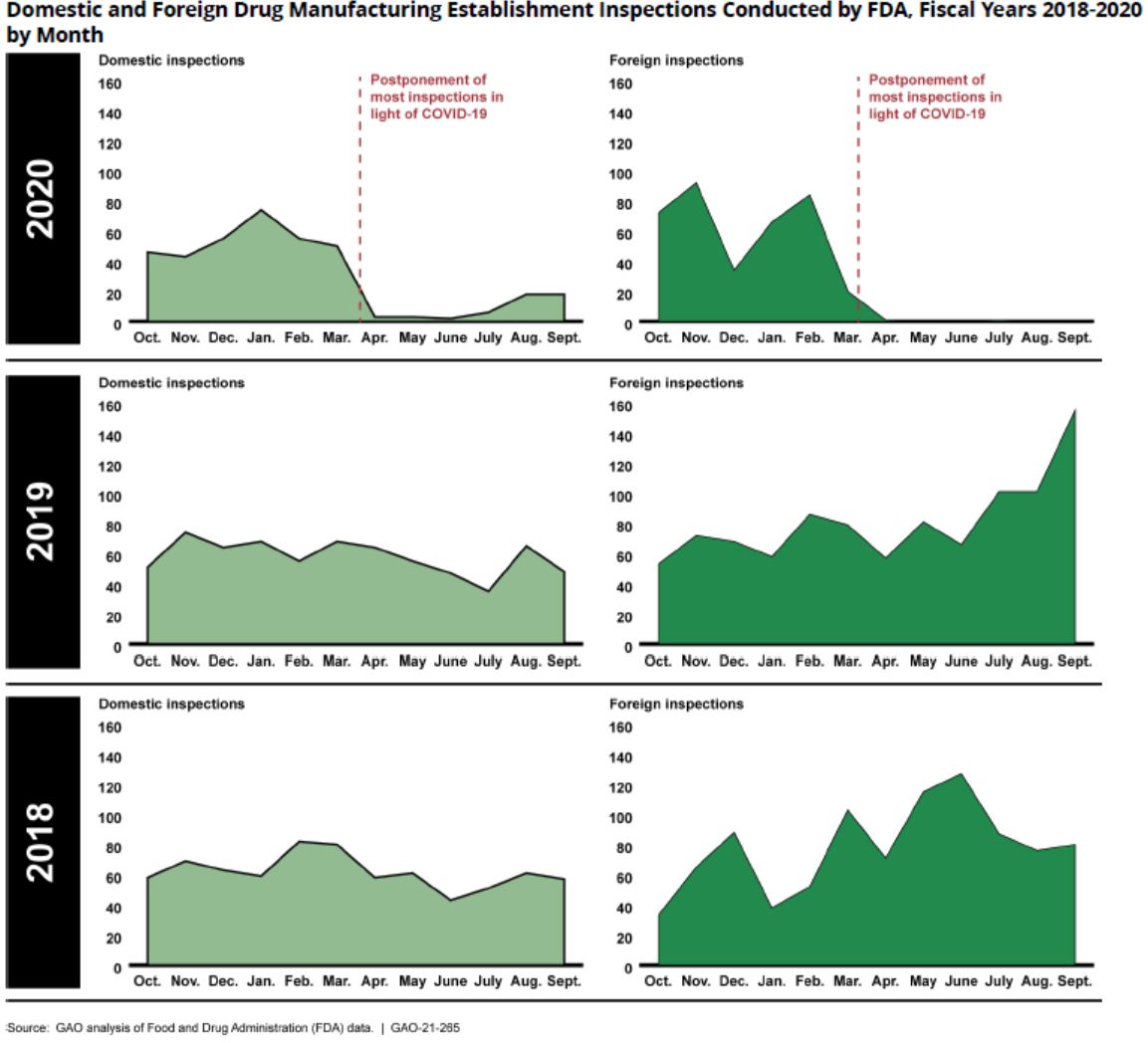
美国政府报告呼吁 FDA 考虑检查替代方法解决积压,...
2021.02.05
美国政府问责办公室(GAO)于 1 月 28 日发布了一份题为《COVID-19:关键疫苗分配,供应链,项目完整性,以及其它需要联邦政府重点关注的挑战》的近 350 页的报告(报告全文和治疗产品、医护用品供应链、卫生保健指标数据收集、药品生产检查、联邦合同、工人安全和健康监督、对渔业...
|

|
英国兴建疫苗制造与创新中心开发新制造工艺
2021.02.05
英国面向未来的疫苗采购吸引了来自英国政府的巨额投资,以及制药行业的资金承诺和学术界的科学专业知识的投入。在英国牛津郡的一个大型中心 — 疫苗制造与创新中心(VMIC)很快将在中央基金的资助下开始运转。
VMIC 的建立是为了促进和加速英国疫苗行业的发展。这是英国第一个专门的...
|

|
FDA 对在中国的检查及远程记录审查的一些说明
2021.02.04
感谢美国 FDA 驻华办助理主任柯雷恩(Lane Christensen)博士的支持,稿件中大部分内容来自 2020 年 10 月 ISPE 年会以及 12 月 CPhI 大会上他的演讲。
昨日我们介绍了【法律专家对 FDA 首封远程记录审查警告信的解析和建议】,今天我们来看看 FDA 对于疫情下的检查...
|

|
FDA 发布 2021 年生物制品相关指南制定计划
2021.02.04
美国 FDA 生物制品审评与研究中心(CBER)发布了其计划于 2021 年新增和修订的指南清单。与上个月 FDA 发布的药品指南制定计划相比【FDA 发布 2021 年药品指南制定计划 2021/01/29】,生物制品指南制定计划显得十分精简,清单仅包括 14 篇指南,比 2020 年指南计划中的 31 ...
|

|
法律专家对 FDA 首封远程记录审查警告信的解析和建...
2021.02.03
2021 年 1 月 22 日,美国 FDA 向宁波余姚市益佳日化公司签发了一封警告信,警告信是 FDA “根据《联邦食品、药品和化妆品法案》(FDCA)第 704(a)(4) 条的规定在 2020 年 3 月 31 日提出了记录和其它信息要求,FDA 审查了益佳日化回复提交的记录”而发出的。这似乎...
|

|
欧盟检查员分享远程 GMP 检查经验,或将成永久性措...
2021.02.03
在正在进行的试点取得早期积极成果之后,欧洲药品质量管理局(EDQM)计划将“实时远程检查”作为其 GMP 检查计划的一项永久性措施。
这项试点是由于与 COVID-19 相关的旅行限制导致的现场检查的推迟而启动的。到目前为止,EDQM 的检查员已经从他们在欧洲的办公桌旁对印度两家制药...
|

|
Recent FDA Warning Letter Highlights Potential R...
2021.02.03
On January 22, 2021, FDA issued a Warning Letter to Yuyao YiJia Daily Chemical Co., Ltd., an over-the-counter drug manufacturer located in Ningbo, China. The Warning Letter was issued based on FDA’s review of “the records Yuyao submitted in resp...
|

|
两项研究揭示雷尼替丁与亚硝胺生成和癌症风险之间的显...
2021.02.02
美国在线药房 Valisure 曾于 2019 年在胃灼热药 Zantac 及其雷尼替丁仿制药中发现异常高含量的致癌性亚硝胺杂质而引发轩然大波。全球十几个国家采取了召回行动。但对于这种常用且一部分产品是作为非处方药出售的胃灼热药引发的恐慌并不止于此,Valisure 进一步指出,雷尼替丁中的亚...
|

|
缬沙坦制药商因亚硝胺杂质问题面临欺诈指控
2021.02.02
缬沙坦中亚硝胺杂质的诉讼案有了新进展,美国新泽西州一名联邦法官于 1 月 29 日对于消费者诉缬沙坦制药商和分销商一案发布意见书,取消了消费者对于缬沙坦仿制药分销商的欺诈指控,但维持了对于制药商的欺诈指控。
新泽西州联邦地区法院法官 Robert Kugler 在意见书中指出,允...
|
|
FDA 对于新冠疫苗儿科保护效力桥接研究方面的建议
2021.02.01
美国 FDA 官员表示,识别保护性免疫相关性将使新冠(COVID-19)疫苗更容易扩展到儿科人群中,但是,缺乏此类相关性并不一定是从成人保护效力数据桥接到儿科人群的障碍。
FDA 疫苗研究与审评部门临床审评副主任 Doran Fink 在 1 月 27 日疾病控制与预防中心(CDC)的免疫咨询委员...
|

|
【一周回顾】2021.01.25-01.31
2021.02.01
国务院发布推动药品集中带量采购工作常态化制度化开展的意见。药审中心发布药物相互作用研究、药物临床试验适应性设计指南。欧盟批准阿斯利康新冠疫苗。美国 FDA 发布 2021 年药品指南制定计划;基于远程记录审查对中国一非处方药公司发出警告信;对来自墨西哥的所有含酒精手消毒液...
|

|
【质量对话】警察的 SOP
2021.01.31
GMP是惩罚性的质量监管手段,是否也可以有激励性的一面呢?
刺槐:众所周知,GMP检查最好的结果就是没有缺陷项。GMP检查是来挑毛病的,不是寻亮点的。对此,药监部门和企业都习以为常,国内外都是。
编辑:难道不对吗?满足GMP是药监部门允许企业卖药的先决条件,是法规强制性要求。...
|

|
FDA 推迟对渤健阿尔茨海默药的审批决定
2021.01.30
根据渤健(Biogen) 1 月 29 日的https//investors.biogen.com/news-releases/news-release-details/biogen-and-eisai-announce-fdas-3-month-extension-review-period 消息,美国 FDA 推迟了对其备受关注的阿尔茨海默症治疗药 aducanumab 的批准决定,要求提...
|
|
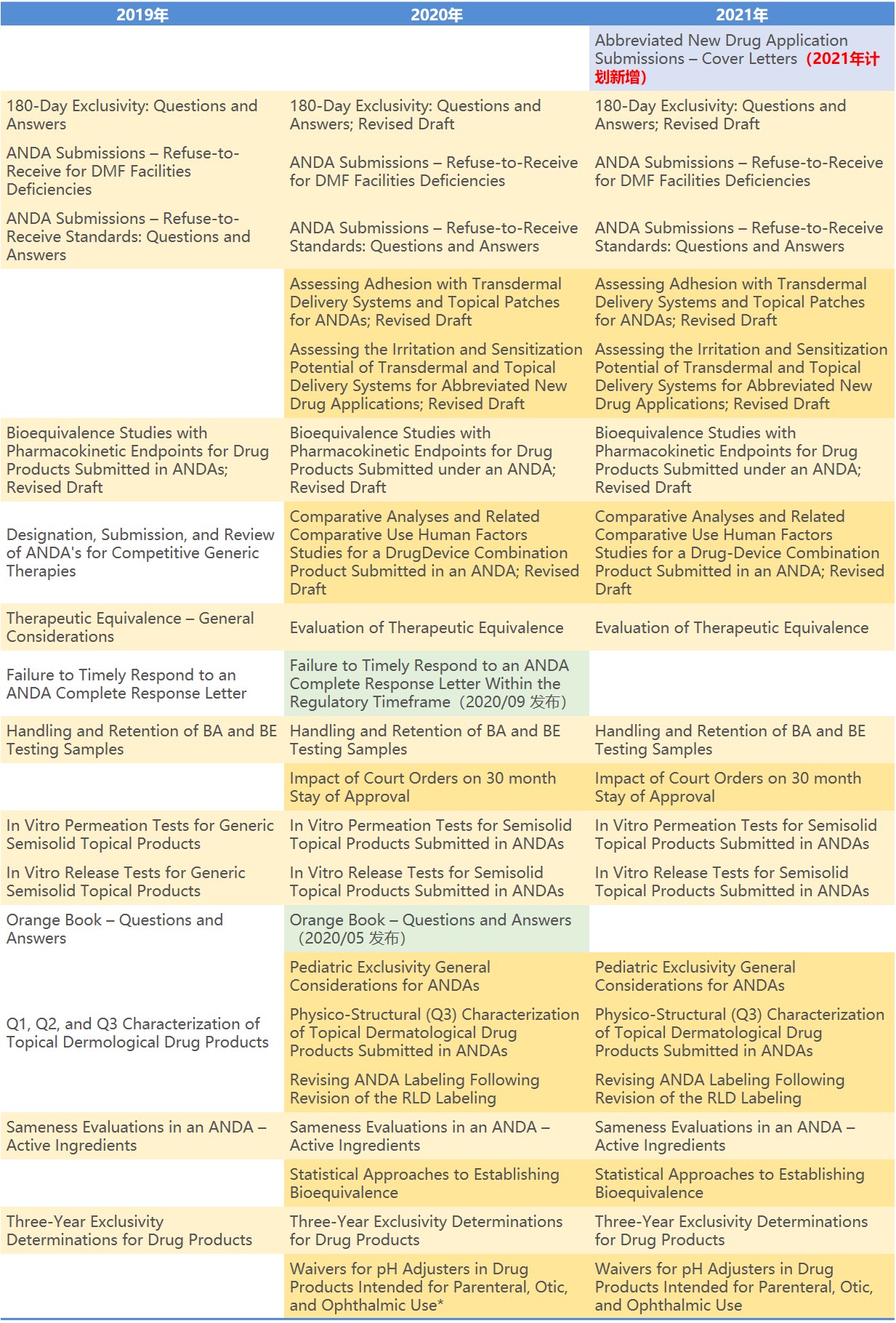
FDA 发布 2021 年药品指南制定计划
2021.01.29
美国 FDA 药品审评与研究中心(CDER)于 1 月 25 日发布了其 2021 年药品方面的指南制定计划,涵盖 18 个类别,共 105 篇计划新增或修订的指南,比去年 2020 年计划的 88 篇文件增加了 18%,其中 42 篇是 2021 年的新指南,剩余的则是从 2020 年的计划清单中遗留...
|

|
美国非营利仿制药组织斥资 1.24 亿美元建基本药物...
2021.01.29
去年春天,非营利仿制药公司 Civica Rx 加入全新的 Phlow 公司,联手推动美国在岸药品生产,提供新冠(COVID-19)治疗所需的基本药物,成为近年来美国一系列试图降低药价、制药业回迁的行动之一。【美国在药品制造回归上迈出了一大步 2020/05/20】
Civica 计划斥资 1.245 ...
|
|
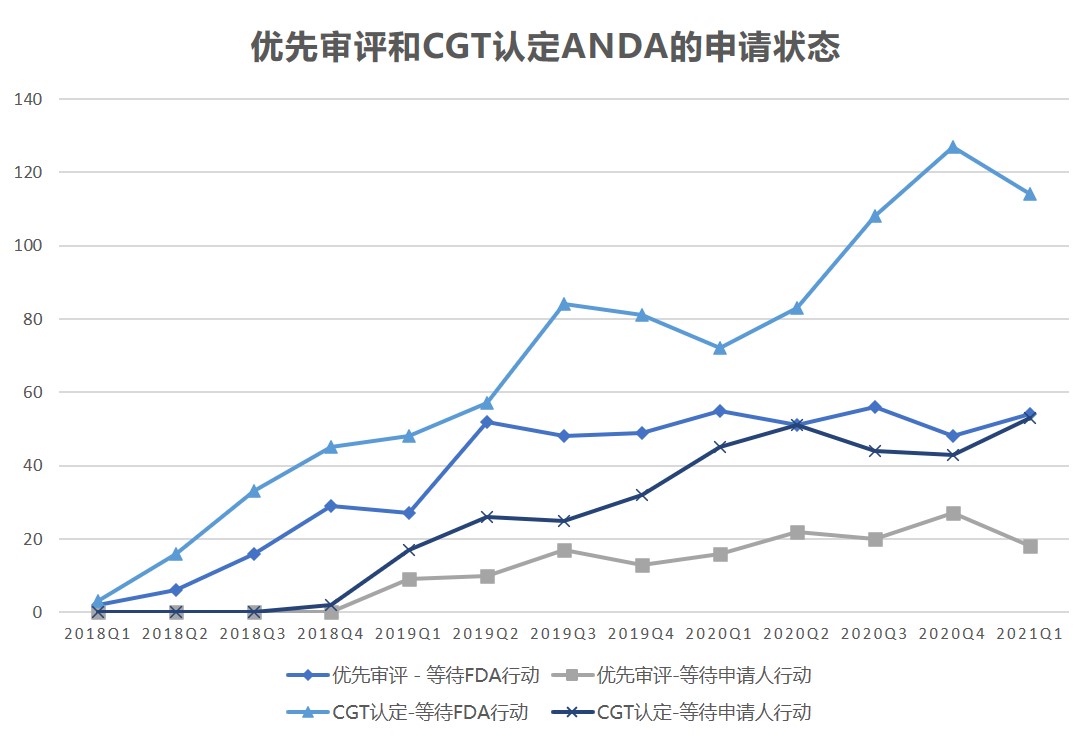
FDA 优先审评和竞争性仿制药申报与审批数据回顾
2021.01.28
美国 FDA 仿制药使用者付费计划 II 期(GDUFA II)实施已有三年的时间,从过去三年的数据看,FDA 批准或正在审评的优先和竞争性仿制药(CGT)简化新药申请(ANDA)正在增加。
根据 2017 年 FDA 重新授权法案(FDARA),其中关于 GDUFA 重新授权的部分包括了在优先审评计划下对...
|

|
疫情加速 FDA 对真实世界数据的使用
2021.01.28
美国 FDA 已推进真实世界数据的使用来应对新冠(COVID-19)大流行,利用这些数据来了解疾病、规划临床试验以及管理医疗产品供应链以预防短缺。
FDA 首席副局长 Amy Abernethy 在 12 月举行的 FDA/CMS 峰会上介绍了 FDA 在大流行期间对于真实世界数据使用的进展。她表示,FDA与 Re...
|

|
FDA 与美国标准和技术研究院合作加快先进制造技术的...
2021.01.27
美国 FDA 和国家标准与技术研究院(NIST)于 1 月 15 日签署了一项为期五年的谅解备忘录(MOU),努力加快制药业中人工智能和机器学习(AI/ML)等新技术的采用,以更好地为未来的供应链中断做准备。
在制药业中对新技术的应用是为了升级过时的制造方法并提高全球药品供应链的弹性。...
|