|
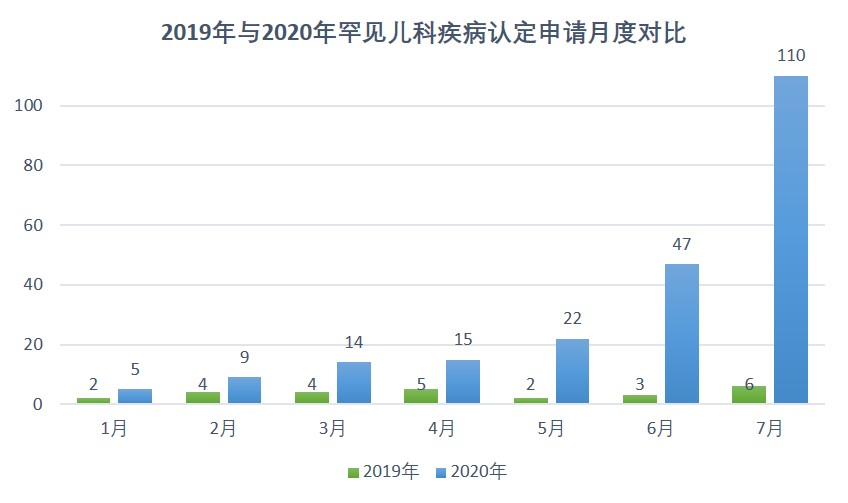
罕见儿科疾病认定请求激增,孤儿药认定申请提交即将电...
2020.09.18
上周,我们提到美国 FDA 罕见儿科优先审评券将于 9 月 30 日到期,可能会获得暂时性为期 4 年的延期,但延期法案仍在立法流程中,并列出了自儿科优先审评券确立以来至今的全部优先审评券清单。【罕见儿科优先审评券将获暂时性延期,全部优先审评券情况一览 2020/09/11】
今...
|

|
研究显示真实世界数据可替代杜氏肌营养不良试验中的安...
2020.09.18
一项针对杜氏肌营养不良症(DMD)的新的跨国、多中心研究表明,利用真实世界和自然历史数据(RWD/NHD)可以补充,甚至可能取代在将来的 DMD 试验中使用的安慰剂组。
该研究由 CureDuchenne(一个 DMD 患者基金)的协同轨迹分析项目(Collaborative Trajectory Analysis Project,...
|

|
重新思考药品监管:加速快跑还是谨慎持重?
2020.09.17
最近在美印商会(USAIC)年度生物制品和医疗保健峰会上,业界讨论了一些有趣且存在争议的内容,关于新冠疫情是否为重新考虑药品监管流程提供了机会。
简化试验,加快监管进程
百康(Biocon)公司董事长 Kiran Mazumdar-Shaw 表示,大流行期间美国的曲速行动(Operation Warp Spe...
|

|
日本癌症中心建立亚洲临床试验网络,推动新型抗癌药的...
2020.09.17
日本国家癌症中心医院(NCCH)启动了一个新的亚洲试验网络,旨在推动新型肿瘤药的早期临床开发,并作为亚洲地区跨国合作的框架。
NCCH 表示,ATLAS((Asian clinical TriaLs network for cAncerS)项目的主要目标包括推进企业申办和研究者发起的关键试验、基因组医学,改善药物...
|

|
WHO 发布使用下一代测序技术检测外源病毒的拟定国际...
2020.09.16
世界卫生组织(WHO)于 9 月 7 日发布了拟议国际病毒参考标准品,用于通过下一代测序技术检测生物产品中的外源病毒。
该拟议基于一个国际研究小组的工作。该研究小组由美国 FDA 生物审评与研究中心的 Arifa Khan 领导,六个国家的八个实验室参加了这项研究,评估了五种参考种...
|

|
欧盟发布大数据工作计划,增强大数据在监管决策中的应...
2020.09.16
欧盟于 9 月 14 日发布了大数据指导小组 2020-2021 年工作计划,概述了一些颇具雄心的项目和任务。但由于监管机构将重点放在疫情应对上,因此这些行动的实施可能会被推迟。
欧盟大数据指导小组由欧洲药品管理局(EMA)和欧盟药品机构(HMA)于今年 2 月份成立,旨在帮助实施 EMA...
|

|
MHRA 总结根源调查的常见问题并给出范例
2020.09.15
调查是任何制药商或批发商运营中不可避免的方面;尽管每个公司都在努力建立完善的系统和流程,但无法预测每种潜在的失败模式并且完全预防事件的发生。英国药品与医疗保健产品监管机构(MHRA)最新的一篇https//mhrainspectorate.blog.gov.uk/2020/09/14/a-fresh-look-at-an-old-topi...
|
|
根源调查中对明辨式思维的应用
2020.09.15
今日的资讯介绍了英国 MHRA 总结的检查员在检查中看到的有关根源调查的一些常见问题,并给出了究竟什么样的调查才是好的调查。那么究竟如何才能更好地在调查中确定或排除潜在根本原因?这篇资讯我们来看看如何运用明辨式思维问出正确的问题,抽丝剥茧找到根本原因。
明辨式思维是经...
|

|
【一周回顾】2020.09.07-09.13
2020.09.14
上周识林更新多份中译指南文件。国家局发布药品专利纠纷早期解决机制征求意见稿,以及新冠中和抗体类药物申报临床药学研究与技术资料试行指南。FDA 发布新冠疫情期间恢复正常药品生产操作的指南文件,公布两封警告信。英国药监局发布脱欧后药物警戒受权人和药物警戒系统主文件的指南。...
|
|
FDA 发布疫情期间制药企业复工复产指南
2020.09.14
美国 FDA 于 9 月 10 日发布《COVID-19 公共卫生紧急事件期间恢复正常的药品和生物制品生产运行》指南,关注疫情下恢复生产,缓解药品短缺并完成隔离批次的质量保证活动。
FDA 在指南中建议,随着 COVID-19 疫情的消退,制药企业在恢复全面 GMP 药品生产运营之时,应优先...
|

|
【质量对话】对 GMP 这个词的感悟
2020.09.13
强调外部的法律或行政强制性,还是其内在的功效?
刺槐:最近对一件困扰我五年的问题有了一点感悟,想与你说说,听听你的想法。
2015年3月,FDA开始着重查中国药企的数据可靠性问题。当时的主要问题之一是QC实验室通过反复试针来达到想要的结果、并掩饰不好的结果。为何这样做不对,...
|
|
FDA 拟发布新冠疫苗紧急使用授权指南,或将要求更多...
2020.09.12
美国 FDA 生物制品审评与研究中心主任 Peter Marks 表示,FDA 可能会采用紧急使用授权(EUA)途径许可新冠疫苗,但全面许可通常会有更严格的安全性和有效性标准。
在 9 月 10 日 Duke-Margolis 卫生政策中心关于 COVID-19 疫苗接种的安全和有效性网络会议上,Marks 将这...
|

|
FDA 专业负责人联名承诺:科学至上
2020.09.12
在《今日美国》 9 月 10 日发表的一篇观点文章中,八名 FDA 职业领导联合表达了对于 FDA 基于科学的决策过程以及如何实现这一过程的承诺。他们在文中做出了这样的保证:科学将决定他们的决策。承诺文章的最后,作者们说承诺只代表他们个人,不代表FDA、卫生部和政府。也就是说,...
|

|
罕见儿科优先审评券将获暂时性延期,全部优先审评券情...
2020.09.11
美国众议院能源和商业委员会于 9 月 9 日向众议院全体会议上呈了一项法案,该法案将继续延长罕见儿科疾病优先审评券(PRV)至 2024 年 9 月 30 日。
美国FDA优先审评券(PRV)计划是指申请符合热带疾病产品或罕见儿科疾病产品资格的申办人在申请获得批准后,可获得相应优先审评...
|
|
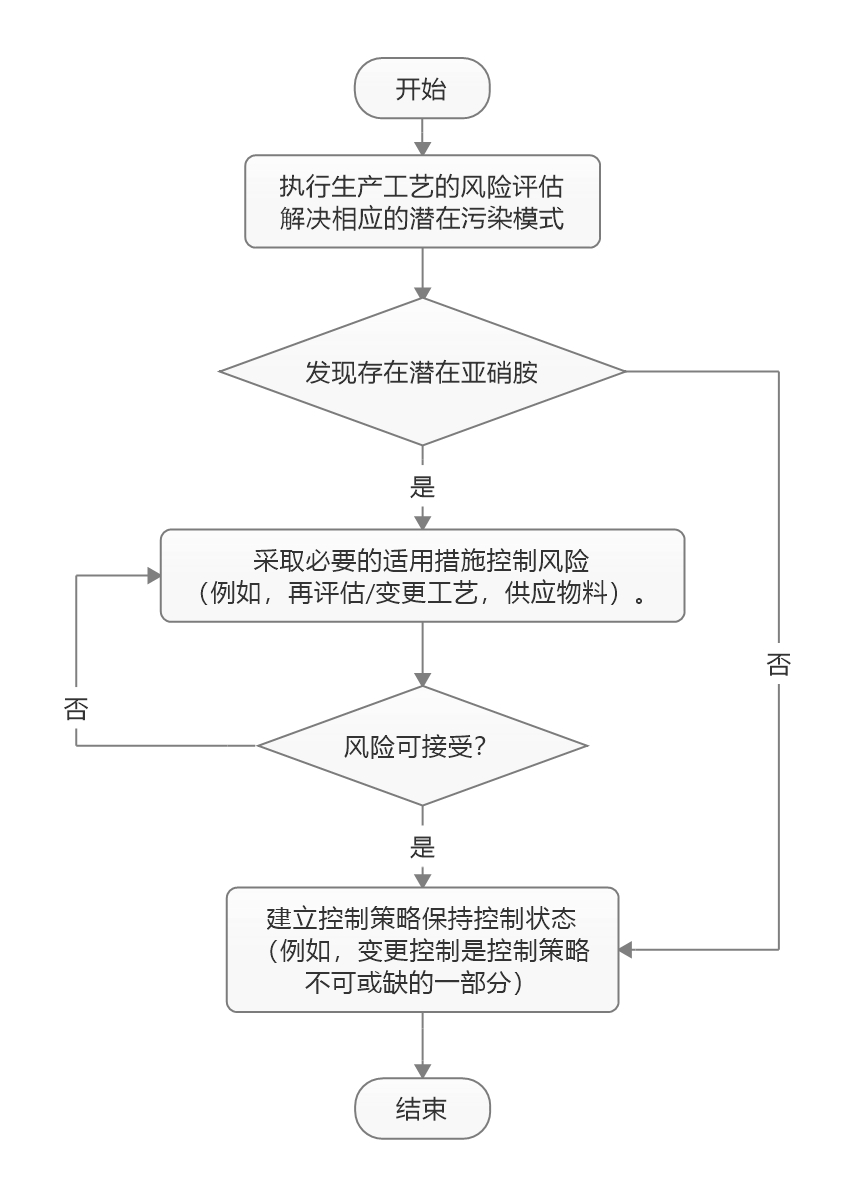
USP 提出亚硝胺杂质新通则章节,列出四种分析方法
2020.09.10
美国药典(USP)已通过提议新的通则章节提出有关如何检测原料药(API)和制剂中的亚硝胺杂质。章节概述了制药商可以用来证明其产品不含不安全水平的潜在亚硝胺杂质的一系列分析方法。
USP 亚硝胺通则章节于 9 月 1 日和 FDA 亚硝胺指南同一天发布,与 FDA 指南的一致之处在于...
|
|
阿斯利康新冠疫苗试验暂停原因披露,且并非第一次试验...
2020.09.10
昨日医药领域最为引发热议的新闻之一恐怕就是阿斯利康/牛津大学 COVID-19 疫苗的 3 期试验因一名参与者出现与疫苗接种相关的疑似严重不良反应而暂停。现在事件又有了最新进展,我们一起来看看。
根据 STAT NEWS 的消息,阿斯利康首席执行官 Pascal Soriot 在美国时间周三上...
|
|
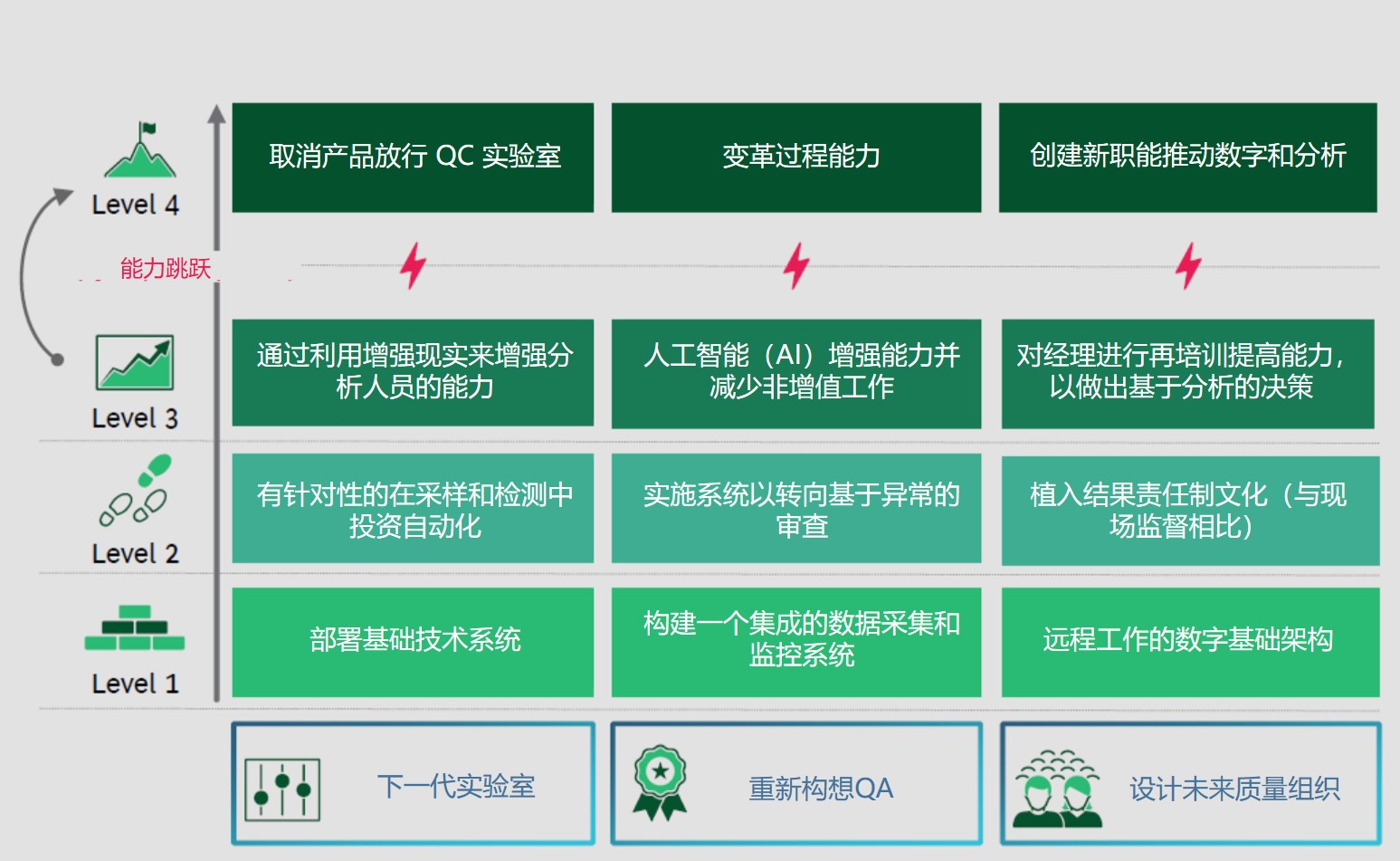
未来质量:下一代QC实验室,重构QA,设计未来质量组织
2020.09.09
印度制药联盟(IPA)和波士顿咨询集团(BCG)最近发布了一份报告,标题为“未来工作:构建未来质量职能”的角色,涉及未来质量组织架构。
COVID-19 大流行的后遗症导致制药企业的质量职能受到多个挑战的困扰,例如,人力不足,远程工作基础设施欠缺,以及供需关系大幅波动。行业已采...
|

|
国际 CRO 组织发布白皮书和工具包促进分散式临床试...
2020.09.09
国际合同研究组织协会(ACRO)最近发布了一份白皮书和基于风险的框架以及行业最佳实践。由于 COVID-19 大流行,分散式临床试验的重要性日益凸显。
ACRO 希望其文件能够“帮助减轻不确定性,并减少对分散式临床试验模型采纳的由于。”虽然 COVID-19 大流行正迫使临床试验方法实现...
|

|
美国药典确定未来五年的 15 个优先事项
2020.09.08
2020 年 5 月,美国药典委员会(USPC)召开网络会议,回顾了其在推进公共卫生方面的核心作用,同时评价了其对 COVID-19 危机迫切需求的应对。会议还通过了 15 项决议旨在设定下一个五年周期的战略重点。
USP 药典委员会会议每五年举行一次,召集有投票权的成员组织代表(现有近 ...
|

|
老药新用:吸入剂再开发的主要考量要点
2020.09.08
开发吸入剂型是老药新用中改善有效性或顺应性并增加商业价值的一种方法,尤其是在对于肺部疾病。今天我们编译了《制药技术欧洲》杂志上一篇关于再开发吸入制剂的文章“Key Considerations When Repositioning a Known Drug for Inhalation Therapy”1 供大家参考。
现有药...
|