
|
FDA 数据可靠性指南 — 亮点与观察
2019.01.12
在刚刚过去的2018年年底,FDA发布了《数据可靠性与药品 CGMP 合规问答》定稿,识林除发布了新旧版本花脸稿、定稿中译外,还对定稿与草案间的差异做了细致的分析。【FDA 数据可靠性问答定稿指南中值得注意的变化 2018-12-14】总体而言,数据可靠性仍是 FDA 的首要执法重点,FDA 将...
|

|
2019 年度 IPEM 课程新亮点与报名问答
2019.01.09
2019年度的IPEM课程顺应国内制药行业与国际、国内外部环境的变化,与时俱进,推陈出新,在全年为期61天的32次课程中,有19天的14次课程是全新的,新课程数量高达43.8%,希望更好地为国内制药行业围绕“创新、质量、效率”的变革做好准备,提供难点、痛点的解决思路和人才储备。【2019 年 ...
|

|
政府进入仿制药生产和分销,是好是坏?
2018.12.20
美国参议员 Elizabeth Warren 日前宣布将发布一份被称为《平价药品制造法案》的新提案1。提案将建立一个药品生产办公室,该办公室将被要求在第一年生产至少 15 种不同的仿制药,这些药品都应该是经办公室确认存在市场失效的药品。Warren 坚称这是政府试图修复系统而不是取而代之。这...
|

|
国际药物工程管理(IPEM)课程教育2019年开始招生!
2018.12.17
立体知识结构 + 综合思考能力 + 国际视野理念
IPEM理念
研制出疗效好质量高药品的关键是对产品和药业有系统和深入的认知。无论是研发、注册、生产、质管、监管还是产业政策,都有很多科学、管理和监管科学的规律性内容。外部环境变化越快,手上问题越复杂,越需要以不变应万变...
|

|
FDA 数据可靠性问答定稿指南中值得注意的变化
2018.12.14
12 月 12 日,美国 FDA 发布了《数据可靠性与药品 CGMP 合规问答》定稿指南,更新了 FDA 于 2016 年 4 月发布的指南草案。该指南覆盖体系和控制的设计、操作和监控以保持数据可靠性(Data Integrity),从而符合药品 CGMP。定稿指南中指出,近年来,FDA 在检查过程中“越...
|

|
FDA 与 MHRA 如何决定检查场地及检查频率
2018.12.13
美国 FDA 今年年初修改了其用于确定哪些国外或国内药品生产场地需要检查或需要其它类型的监督检查以及检查频率如何的方法。同时,FDA 还引入了一个多年期资源规划过程,使其能够更好地利用资源、规划产品抽样和检查频率。
FDA 药品审评与研究中心(CDER)药品质量办公室(OPQ)下属...
|

|
数据可靠性带来了爱克龙的“凛冬”
2018.11.28
爱克龙再次因质量管理被FDA发出483信:
爱克龙(Akorn)是一家美国仿制药生产企业,专注于生产眼科用药,注射剂,口服液,耳药,局部药,吸入剂和鼻腔喷雾剂等。它的研究和生产设施分布在美国、印度及瑞士。仅在今年,其下属的两个生产设施(分别位于新泽西州萨摩赛特和伊利诺伊州迪凯特...
|

|
FDA 局长及药品中心主任再谈药品短缺解决之道
2018.11.26
【编者按】美国 FDA 局长与药品中心主任日前在 FDA Voice 上发表联名文章,介绍 FDA 在药品短缺方面过去、目前与将来的努力,讨论了短缺问题的深层次原因,并号召各界参与协作,共同解决问题。
我们公共卫生使命的一个关键组成部分是帮助确保美国民众获得安全有效的药品。这就是...
|
|
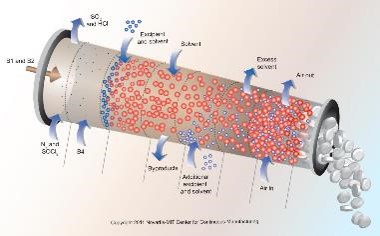
FDA 采用更多建模工具支持连续制造
2018.11.24
在日前举行的ISPE年会和美国制药科学家协会会议上, FDA官员提到连续制造的“不断增长的牵引力”以及更多使用建模支持这种制造模式,同时说明在检查过程中如何评估这些模型。FDA官员报告,制药行业对使用工艺过程建模工具支持连续制造越来越感兴趣。在与FDA举行的会议上,申请人纷纷显示...
|

|
ICH 是否真地实现了全球协调?
2018.11.13
全球监管机构的协调统一并不是件易事,首先各机构对于同一概念的定义就有所不同,更不用说各国的法规要求和监管传统。仿制药界资深人士 Bob Pollock 给我们带来了他在第四届全球监管事务 CMC 会议上对于 ICH 指南在各国协调实施过程中存在的问题的观察。会议于 10 月 29 -30 ...
|

|
FDA 局长表示将在两年内全面实施新检查方法
2018.11.12
美国 FDA 正在通过一种评估、记录和报告无菌药品监督检查和批准前检查数据的新方法来现代化其检查项目。FDA 局长 Scott Gottlieb 在一份声明中表示,将在未来两年内全面实施这种新检查方法。
新检查方案项目(New Inspection Protocol Project,NIPP)使用标准化的电子检查方...
|

|
美国医院联盟的带量采购:天才计划还是理想主义?(下...
2018.11.06
上回说到,Civica模式听起来是个聪明完美的计划。需求端,有大型连锁医院的长期带量承诺,不用对任何人做销售广告;供应端,有不逐利的非营利组织,设置公平透明的价格承诺不变,提供可靠稳定的货源;机构本身,有多年质量管理经验的新药公司高管免费出任CEO,有持续资助的慈善金主。然而Ci...
|

|
美国医院联盟的带量采购:天才计划还是理想主义?(上...
2018.11.05
上个月识林曾报道过1 包括梅奥、HCA等在内的7家大型医疗服务商联合计划,他们将联合起来创建一家非营利性仿制药公司,以期对抗天价药和美国患者经常性面临的药品短缺。9月这家公司正式成立,取名为Civica Rx。作为非营利机构2 ,Civica设立董事会,药品遴选委员会和药品短缺趋势委员会...
|

|
PICS 将发布关于 GMP 缺陷分类的新指南
2018.11.03
国际药品检查合作计划组织(PIC/S)于 9 月 24-25 日在美国芝加哥举办的 PIC/S 委员会会议期间表示正式通过了一份关于 GMP 缺陷分类的新指南(PI 040-1)。该指南将于 2019 年 1 月 1 日生效之前发布在 PIC/S 官网。
指南的目的和范围是协调 GMP 缺陷分类,以促进...
|

|
厄贝沙坦进入缬沙坦杂质事件波及范围
2018.11.01
美国 FDA 于 10 月 30 日发布更新,ScieGen 公司自愿召回某些批次的厄贝沙坦(irbesartan)。这是自缬沙坦基因毒性杂质事件爆发以来 FDA 发现的含有相同杂质的首个非缬沙坦药品。厄贝沙坦同缬沙坦一样也是一种血管紧张素 II 受体阻断剂(ARB),用于治疗高血压和心力衰竭。FDA 实验室...
|
|
FDA 针对供应链确证系统发布指南草案
2018.10.31
随着越来越多的《药品供应链安全法案》(DSCSA)要求呼之欲出,美国FDA近期发布了《某些处方药以药品供应链安全法案为依据的确证系统》指南草案,该指南讨论了确证(verification 或 verify)过程以及FDA对于确保在DSCSA下产品合法的期望。
FDA发布该指南以描述FDA对FD&C法案第582条...
|

|
FDA 在药品短缺问题上的新举措
2018.10.25
美国 FDA 宣布将于 11 月 27 日召开公开会议,给包括医疗保健提供者、患者、生产商、批发商、药剂师、药房福利管理人员、兽医、公共和私人保险公司、学术研究人员以及公众在内的利益攸关方提供机会,就药品短缺的潜在系统性原因提供意见并就预防或缓解药品短缺的行动提出建议。
...
|

|
FDA 谈数据可靠性及其与质量文化的关联
2018.10.24
美国 FDA 官员最近对美国和欧盟执法行动的分析显示,在全球监管机构质疑产品质量开始打击数据可靠性(data integrity)问题数年之后,这一问题继续困扰着制药行业。
FDA 药品审评与研究中心(CDER)合规办公室部门主管 Carmelo Rosa 上个月在普享药协会(AAM)主办的 GRx+Biosi...
|

|
2018 秋季统一议程:FDA 推进健康与安全的新监管工...
2018.10.19
(译自 FDA Voice https//www.fda.gov/NewsEvents/Newsroom/FDAVoices/ucm623619.htm “Fall 2018 Unified Agenda FDA's New Regulatory Work to Advance Health and Safety” 2018 年 10 月 17 日,作者:Scott Gottlieb,医学博士,美国 FDA 局长)
2018 年...
|

|
国际药品危机事件管理的法律、商务和技术考虑
2018.10.18
IPEM – 识林 专题课 (第二轮通知)
国际药品危机事件管理的法律、商务和技术考虑
2018年11月9-10日,北京
识林资讯 2018年9月30日,发布了专题课的首轮通知,及课程背景介绍。部分读者希望进一步了解课程细节,本篇资讯应此而生。
专题课将从商务、法律、公众和政...
|