
|
新修订药品管理法表决通过,附答记者问摘录
2019.08.26
摘要:
1. 对药品管理法的全面修改体现了“四个最新”。
2. 鼓励药物创新方面的举措。
3. 上市许可持有人制度。
4. 儿童用药。
5. 药品追溯制度。
6. 未经批准进口的药品,网上售药。
7. 最严厉处罚。
8. 与疫苗法的衔接。
今日上午(2019 ...
|

|
研究显示 EMA 和 FDA 在批准决策方面高度一致
2019.08.26
根据一项最新研究对欧洲药品管理局(EMA)和美国 FDA 在 2014 年至 2016 年间 107 件申请的分析显示,两家机构对超过 90% 的申请做出了同样的决策。这项 7 月份发表在《临床药理学与治疗学》杂志上的研究是两家机构间开展的首项此类研究。
研究者表示,EMA 与 FDA 之间...
|

|
病毒和细菌:新一代护肤品?
2019.08.24
痤疮治疗市场同时存在过饱和与治疗欠缺的情况。当然皮肤护理市场有各种支柱品牌和功能性产品,同时还有一些需要去皮肤科医生那里通过处方才能获得产品,例如仿制维甲酸和抗生素。但有一天痤疮治疗可能会有新选择:细菌和病毒。
随着科学家们发现有关皮肤微生物组的更多细节,小型初创公...
|
|
FDA 标签或考虑通过 PKPD 建模分析增加剂量灵活性
2019.08.21
美国 FDA 药品审评与研究中心(CDER)临床科学中心副主任和新药办公室直属办公室高级顾问 Robert Temple 建议 FDA 考虑将药代动力学(PK)和药效学(PD)建模分析添加到药品标签中,以作为指导剂量个体化的一种方式。FDA一般不允许在药品标签中添加未经确证性研究的剂量,而通过 PK...
|
|
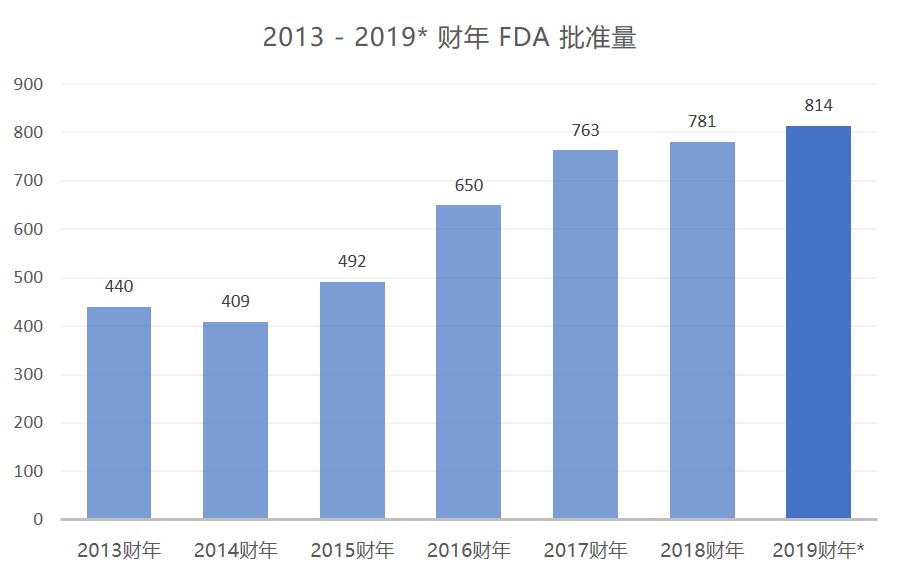
FDA 仿制药批准再创纪录,但问题依旧
2019.08.19
美国 FDA 继续保持其仿制药批准大踏步前进,距财年结束还有两个月的时间,批准量已创历史新高。
FDA 在 7 月份公布了 61 件 ANDA 完全批准后,本财年前 10 个月的批准总数已达 814 件,首次突破 800 并打破了 2018 财年 781 件完全批准的记录。按照此速度,FDA 在本财年...
|

|
申报前会议可能给 EMA 审批过程带来偏见?
2019.08.16
经过两年的调查,欧洲监察使建议欧洲药品管理局(EMA)采取几项措施,以确保与制药商就上市申请进行的申报前会谈不会影响审批决定。
欧洲监察使 Emily O'Reilly 对于企业与监管机构之间申报前的会谈表示担忧并展开调查,她指出,这些会谈可能会产生偏见,或者企业可能会以某种方式...
|

|
FDA 最后通牒:企业需在一个月内更新药品登记信息
2019.08.15
有药品在美国 FDA 注册的企业请注意,请立即采取行动,确保场地信息、药品登记信息和生产场所正确无误,否则药品可能被禁止在美国销售。
FDA 于 8 月 13 日宣布将于一个月之后(9 月 12 日)清理其数据库,撤销那些没有按法规要求更新或认证的药品上市登记(drug listing)...
|

|
FDA生似药比对分析评价指南行业反馈摘选
2019.08.14
生物类似药申办人对于美国 FDA 放弃对一些比对分析评价要求统计等效性检验要求的决定普遍表示支持,但对于定量数据分析、参照标准品确认和国外参比品的使用持怀疑态度。
FDA 于今年五月份发布《治疗性蛋白质生物类似药的开发:比对分析评价和其它质量考量》指南草案(中文翻译),修...
|

|
请小公司代报新药避缴 PDUFA 费,机关算尽反误卿
2019.08.10
一药企因付费请两家小公司分别向美国 FDA 提交两个氯化钾口服溶液的新药上市申请(NDA)被罚款 400 万美元。而这家药企这样做的目的原本是为了节省 220 万美元的处方药使用者付费法案(PDUFA)下的申请费。
Lehigh Valley 技术公司,现称为 Genus 生命科学公司,被指控向两...
|

|
透彻理解,有效控制 — 记口服固体缓控释制剂青岛专...
2019.08.08
2019年8月3-4日,由北京大学药物信息与工程研究中心主办、青岛百洋制药有限公司承办的“口服固体缓控释制剂专题会”在美丽的海滨城市青岛成功举办,近200名来自中美药品监管机构、药品研发机构、制药企业、医疗机构和大学院校等单位的专家和业内人士参会,参会者中还有十多名IPEM的学员...
|

|
诺华基因治疗药陷数据可靠性泥淖,知情迟报或加重问题...
2019.08.08
美国 FDA 严肃声明,诺华及其子公司 AveXis 公司可能会面临民事或刑事诉讼,不仅是因为操纵用于 Zolgensma 基因治疗药物批准的数据,更是因为公司在产品批准前就知道了这个问题但并没有向 FDA 披露。
FDA 生物制品审评与研究(CBER)主任 Peter Marks 在 8 月 6日的一份声...
|

|
ICH Q12 在日本和加拿大的进展情况一瞥
2019.08.05
加州分离科学学会(CaSSS)每年夏天都会在美国华盛顿特区举行一个为期两天的互动论坛,即 CMC 战略论坛。今年论坛的题目是“批准后变更的未来即将来临 — 你准备好迎接 ICH Q12 了吗?”这是一次非常及时的会议,因为预计 Q12 指南将于今年 11 月份在下一次 ICH 大会上进展到第...
|

|
FDA公布处方药、生物类似药、动物药2020财年费率
2019.08.03
前不久美国 FDA 公布了 2020 财年仿制药使用者付费(GDUFA II)的费率标准,识林专文对比了费率方面的变化【FDA公布2020财年GDUFA费率,项目费大幅下降 2019/07/27】。现在 FDA 相继公布了另外一些使用者付费计划 2020 财年费率,我们简要查看一下各个计划的费率情况。
处...
|

|
FDA撤销厂房设施信息递交指南,为什么?
2019.07.31
监管政策制定是政府、企业和社会共同探索的过程,这一过程向全社会的公平、公开、透明是确保制定出行之有效的政策的基础。
美国 FDA 于 7 月 22 日宣布撤销其在 2016 年 12 月 28 日发布的《以电子格式提供监管信息 — 制造设施信息的递交》(Providing Regulatory Submissions in ...
|

|
FDA公布2020财年GDUFA费率,项目费大幅下降
2019.07.27
美国 FDA 于 7 月 26 日宣布了 GDUFA II 期第三个年头 — 2020 财年(2019 年 10 月 1 日起至 2020 年 9 月 30 日止) 的费率,大多数收费类别均有所下降,其中项目费降幅最大,下降了近 11%,相当于为大公司节省了二十万美元。
另外,由于 FDA 在设定 20...
|

|
行业对 ICH Q12 五味杂陈,部分企业已制定实施计划
2019.07.26
虽然工业界对于 ICH Q12 指南是否会放松批准后变更程序持怀疑态度,但这并没有阻止业界为今年晚些时候可能发布并施行的定稿指南做好准备。一个好消息是,美国 FDA 保证,对于旧有产品,制药商将不需要生成太多新数据来证明 ICH Q12 下批准后变更的合理性。相反,他们应该能够利用...
|

|
FDA 代理局长谈未来工作重点
2019.07.25
美国 FDA 代理局长 Norman Sharpless 在 7 月 23 日发给全体工作人员的题为“现代化工作框架以提高患者和消费者获益”的备忘录邮件中阐述了四项主要工作重点,希望在其剩下的短暂代理局长期间产生重大影响,包括:通过新兴技术保障公众健康,投资 FDA 下一代专家工作人员和基础...
|

|
口服固体缓控释制剂专题青岛会议(第三轮通知)
2019.07.24
高端制剂暑期论坛
口服固体缓控释制剂专题青岛会议
第三轮通知
2019年8月3 - 4日
青岛海泉湾皇冠假日度假酒店
主办单位:北京大学药物信息与工程研究中心
承办单位:青岛百洋制药有限公司
支持单位:上海安必生制药技术有限公司;北京宽见科技有限公司
...
|

|
ICH Q12 将于年底发布,FDA 已启动审评员培训
2019.07.23
ICH Q12 《药品生命周期管理的技术和监管注意事项》指南预计将于 11 月获得最终批准,将克服与欧盟不同立法体系的冲突,并更为清晰地阐明既定条件(established condition)相关内容。另外,FDA 正针对 Q12 的一些关键原则对员工进行培训,以确保审评的一致性。
7 月 15 日在美国...
|
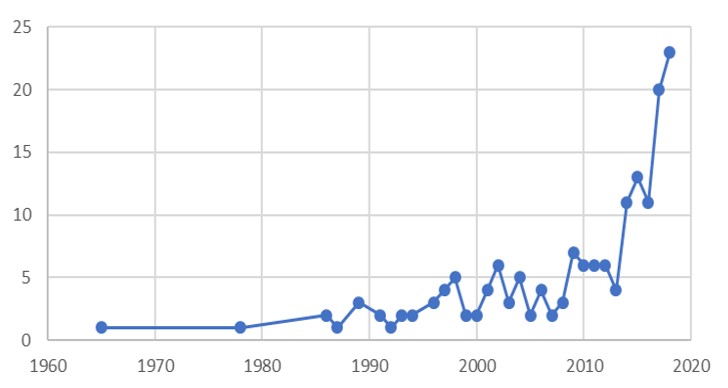
|
从 FDA 批准数据看生物药发展趋势
2019.07.22
2019 年已经过半,我们趁现在来找个机会看看 FDA 和行业在生物药申请批准方面做的如何,同时将这类产品的批准情况放入历史的长河中看看有着怎样的趋势和变化。
从 1965 年到 2013 财年结束,FDA 批准了大约 86 个治疗性生物制品(TBP)。早期,批准率非常缓慢,前 22 年间仅有...
|