
|
【周末杂谈】足够好的质量和足够低的价格
2020.04.26
受国际形势变化的影响,中国出口欧美的医药产品,本已进入逆风时代。新冠疫情只是加快了进程,加强了风力,扩大了影响面。这不,疫情还没过,正当各地官方和民间争先恐后地向中国购买紧缺的防疫物资和医药产品的时候,“非中国造,Not Made in China”的说法,就已经开始散布。类似或...
|

|
适应性临床试验需更有效地管理和质量控制
2020.04.25
适应性临床试验有许多好处,但是需要有效地管理才能成功,在适用性试验设计中尝试新要素的公司应投入更多资源,以应对通常与此类研究相关的额外工作量,否则适应性试验最终可能会出问题。
英国药品监管机构(MHRA)GCP 资深检查员 Mandy Budwal-Jagait 在 2 月份 MHRA 主办的 G...
|

|
更快获得新冠疫苗:监管机构应如何做?
2020.04.24
新型冠状病毒疫情(Covid-19)在大部分地区正趋于稳定,许多国家和地区开始讨论逐步恢复到“正常”状态,但是在没有疫苗的情况下是很难恢复到大流行之前的常态的。目前有 70 多个在研疫苗,那么距离疫苗真正可用的那天还有多久呢?曾在 FDA 作为病毒学家任职 15 年并且是 FDA ...
|

|
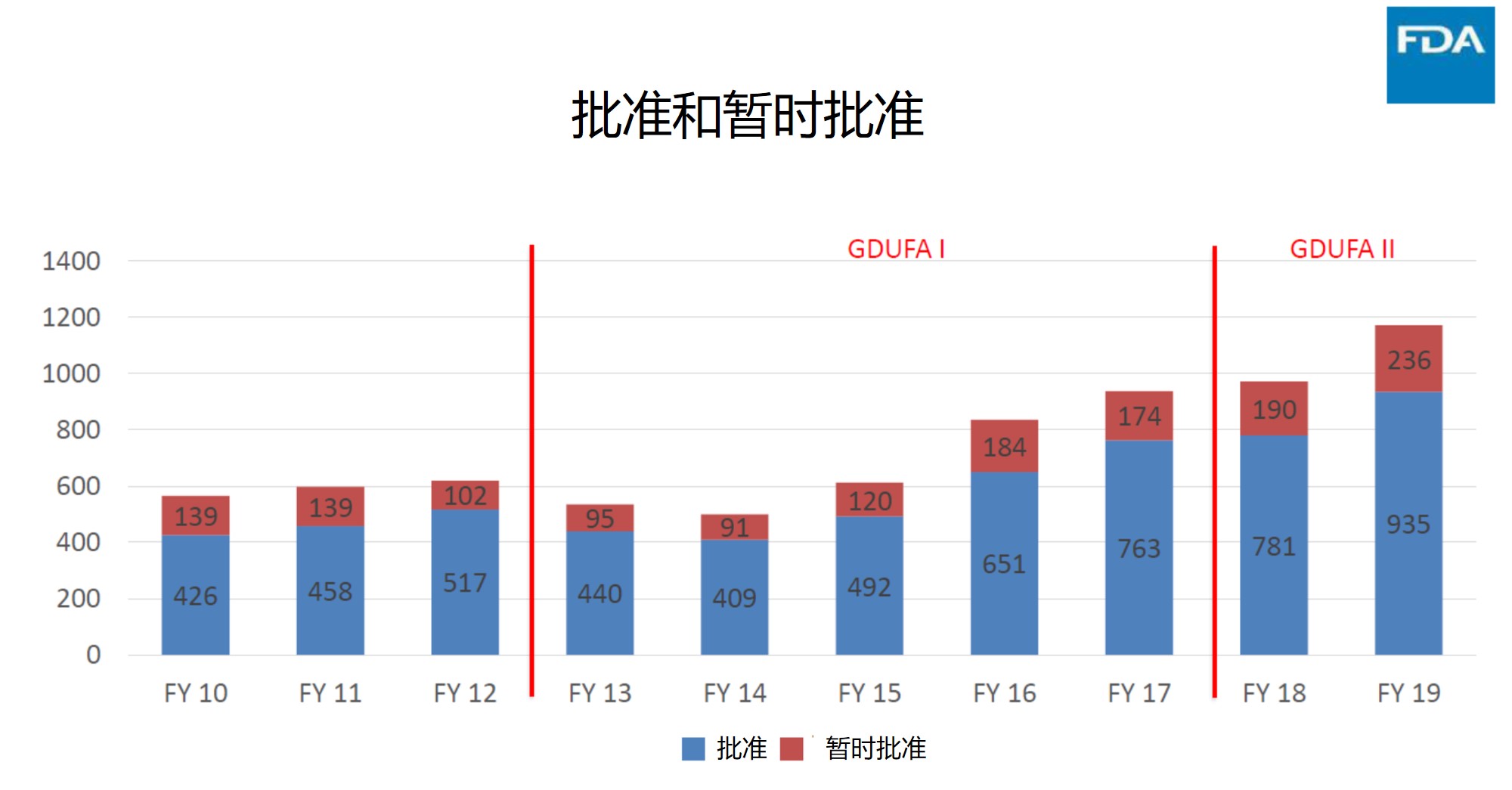
支持 FDA 药品批准所需关键临床试验数量呈下降趋势
2020.04.24
纵观过去 30 年间美国 FDA 对新药和生物制品的批准,越来越多的批准使用加快审评程序,并且所需关键试验有所减少。
4 月 21 日发表在 JAMA Network Open 上的一篇研究文章《1995-2017 年支持美国 FDA 新药批准的临床试验评价》1汇总了 1995-2017 年间 FDA 批准的 2...
|

|
新冠疫苗安全性监测和伴随用药研究成为全球监管关注重...
2020.04.23
欧洲药品管理局(EMA)预计,到今年年底,将建成一个新系统来密切监视在欧盟使用的新冠(COVID-19)疫苗的安全性和有效性。英国也宣布计划通过使用初级医疗卫生数据库 CPRD(临床实践研究数据链)执行国家疫苗警戒实时监控。
EMA 在 4 月 6 日药品监管机构国际联盟(ICMRA)主持...
|

|
业界再提新证据反对 FDA 生物类似药命名和可互换性...
2020.04.23
业界再次组织新证据呼吁美国 FDA 改变其对生物类似药的命名政策,并重新考虑为证明生物类似药可互换性而进行多次转换研究的需求。
上个月,由 FDA 和联邦贸易委员会(FTC)联合召开的关于生物类似药竞争性市场的研讨会【FDA联手FTC与业界共同商讨如何促进生物类似药竞争 2020/03/...
|
|
欧盟发布指南保障和评估新冠病毒体外诊断产品性能
2020.04.22
欧盟委员会(EC)于 4 月 15 日发布《关于 COVID-19 体外诊断检测产品及其性能的指南》,制定该指南的原因主要是新型冠状病毒(COVID-19)检测产品的预期质量与实际质量存在差距,指南是“欧洲解除冠状病毒控制措施路线图”的一部分。
欧盟各国政府正在努力提高检测能力,并且...
|

|
FDA 紧急授权首款新冠检测居家采样套件
2020.04.22
美国 FDA 于 4 月 21 日批准了首款可在家采集样品的新冠病毒(COVID-19)检测的紧急使用授权(EUA)。这一 EUA 标志着 FDA 首次许可居家 COVID-19 检测,并且结束了 FDA 与试图开发自己的居家检测产品的初创公司之间的拉锯战。
FDA 在 3 月 16 日就已经批准了 LabCo...
|

|
哪些变更需要立卷审查 — FDA 修订审评程序手册
2020.04.21
美国 FDA 于 4 月 17 日发布对《MAPP 5200.7 由立卷审查处审核 ANDA 增补和补充申请》的第1版修订,在这份 MAPP 中,FDA 解释了其在包含变更的待审 ANDA 的增补或已批准申请的补充申请方面的决策过程,工作程序和职责。
需要立卷审查的变更包括:
新规格(即,除 AN...
|

|
美国疾控中心实验室污染导致新冠病毒检测贻误时机
2020.04.21
【编者按】科学家素以个体创新为荣。GMP 则以“循规蹈矩”为本,是对千篇一律的崇拜(worship of sameness)。产品的规模生产或制造,离不开GMP,但有些科学家却不以为然。以研发能力强著称的全球生物药巨头Genentech,在这方面曾遭遇过挫折。如今,科学家聚集的美国 CDC 又在疫情...
|
|
FDA 仿制药论坛上报告的一些审批数据及申报建议
2020.04.20
美国 FDA 于 4月15-16日举行了为期两天的仿制药论坛,会上有许多精彩话题,包括具体产品指南、仿制药办公室(OGD)标签审评和要求的介绍、简化新药申请(ANDA)与FDA的互动、电子提交、ANDA 计划绩效审查和改善 ANDA 质量的小贴士,以及根据行动函时间对一些申请的案例研究。另外还...
|

|
【更新提示】识林一周回顾(20200413-0419)
2020.04.20
自新版《药品注册管理办法》发布后,各种宣贯解读会频繁,识林统一整理了各类解读;美国 FDA 在疫情紧张的情况下仍对亚硝胺杂质保持关注,新发布关于尼扎替丁的召回公告;FDA 发布关于磷酸氯喹和硫酸羟氯喹的生物等效性指南,符合条件的可豁免生物等效性研究,有意向的仿制药商可对照...
|

|
【质量对话】通向 Covid-19 疫苗之路的系列短片
2020.04.19
编辑: 美国强生公司从本周开始,每周二播放30分钟一集,共八集的系列报道“通向疫苗之路 (The Road to a Vaccine),网址:JNJ.com/roadtoavaccine”,由新闻记者和制片人Lisa Lin播出。这周播出的第一集的标题是“Covid-19疫苗可能的作用是什么?需要多久才能研制出来?”主...
|
|
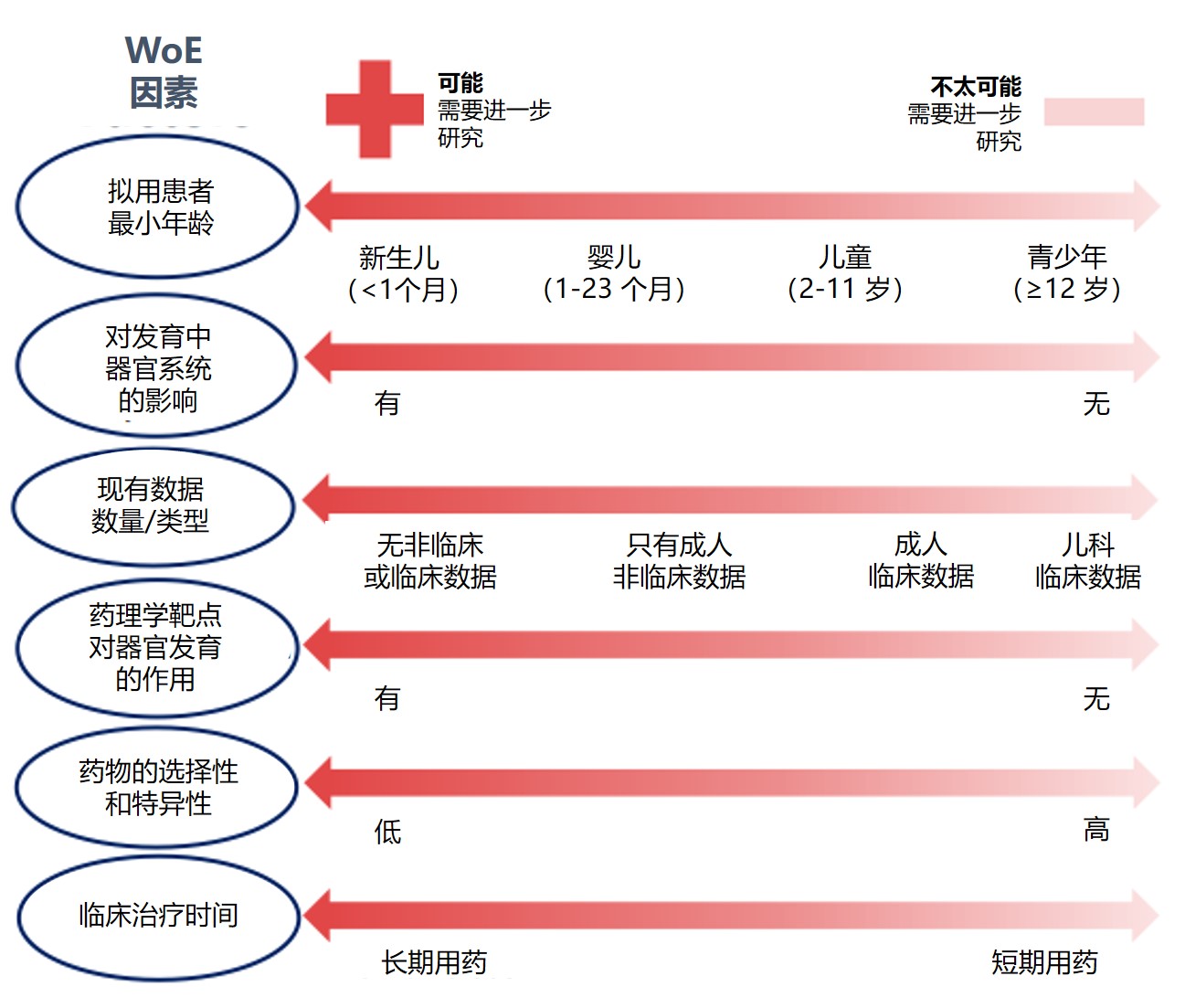
ICH 发布 S11 促进儿科试验并减少动物使用
2020.04.18
ICH 于 4 月 14 日发布 S11《支持儿科药物开发的非临床安全试验》定稿指南,阐明了关于何时以及如何通过非临床幼体动物试验支持儿科药物开发计划。
这份 39 页的指南于 2014 年首次由 ICH 指导委员会确定为指南主题,提出了针对 ICH 地区非临床儿科安全性测试的统一建议...
|

|
欧盟关注临床试验使用的计算机化系统验证
2020.04.17
欧洲药品管理局(EMA)最近发布通告,表达了对最近检查揭示的临床研究中使用的计算机化系统缺乏验证和确认的关注。
EMA 在通告中表示,未能记录和证明计算机系统的已验证状态可能会对数据完整性、可靠性和稳健性造成威胁。取决于受影响数据的严重程度,可能会导致 GCP 检查员建议不...
|

|
哈佛教授呼吁 FDA 勿因大流行而降低审评审批标准
2020.04.17
哈佛大学医学院两名教授日前在《新英格兰医学杂志》上撰写观点文章“Drug Evaluation during the Covid-19 Pandemic”,认为在新型冠状病毒疫情(Covid-19)大流行期间,美国 FDA 最近对两个抗疟疾药氯喹和羟氯喹的紧急使用授权(EUA)可能会破坏药品审批的金标准,进而削弱公众对...
|

|
制药商与CDMO如何应对大流行带来的供应链挑战
2020.04.16
在新型冠状病毒疫情(COVID-19)大流行的巨大压力下,随着制药商、供应链合作伙伴和监管部门的通力合作,原先死板的药品供应链工作流程开始变得异常灵活。制药商 Gilead 以及合同组织 Vetter 和 Lonza 的专家在 4 月 2 日 ISPE 主办的大流行供应链网络研讨会上分享了他们在大...
|

|
药品供应链中实现态势感知的五个步骤
2020.04.16
无论是临床还是商业化供应链管理,保持态势感知(Situational Awareness)都非常重要。态势感知是对关于时间或空间的环境要素和事件的感知,对其含义的理解以及对一些变数和未来状态的预测。
为应对当前全球范围的新型冠状病毒疫情(COVID-19)大流行,很多国家和地区都采取了不同程...
|
|
沙丁胺醇吸入器首仿药提前获批,或与疫情期间需求增加...
2020.04.15
美国 FDA 于 4 月 8 日批准了 Proventil HFA(硫酸沙丁胺醇)计量吸入器的首个仿制药,用于治疗或预防 4 岁及以上可逆性阻塞性气道疾病患者的支气管痉挛,并预防该年龄段运动引起的支气管痉挛。Proventil HFA 的原研商为美国默克公司,此次批准的首仿生产商为印度 Cipla 公...
|
|
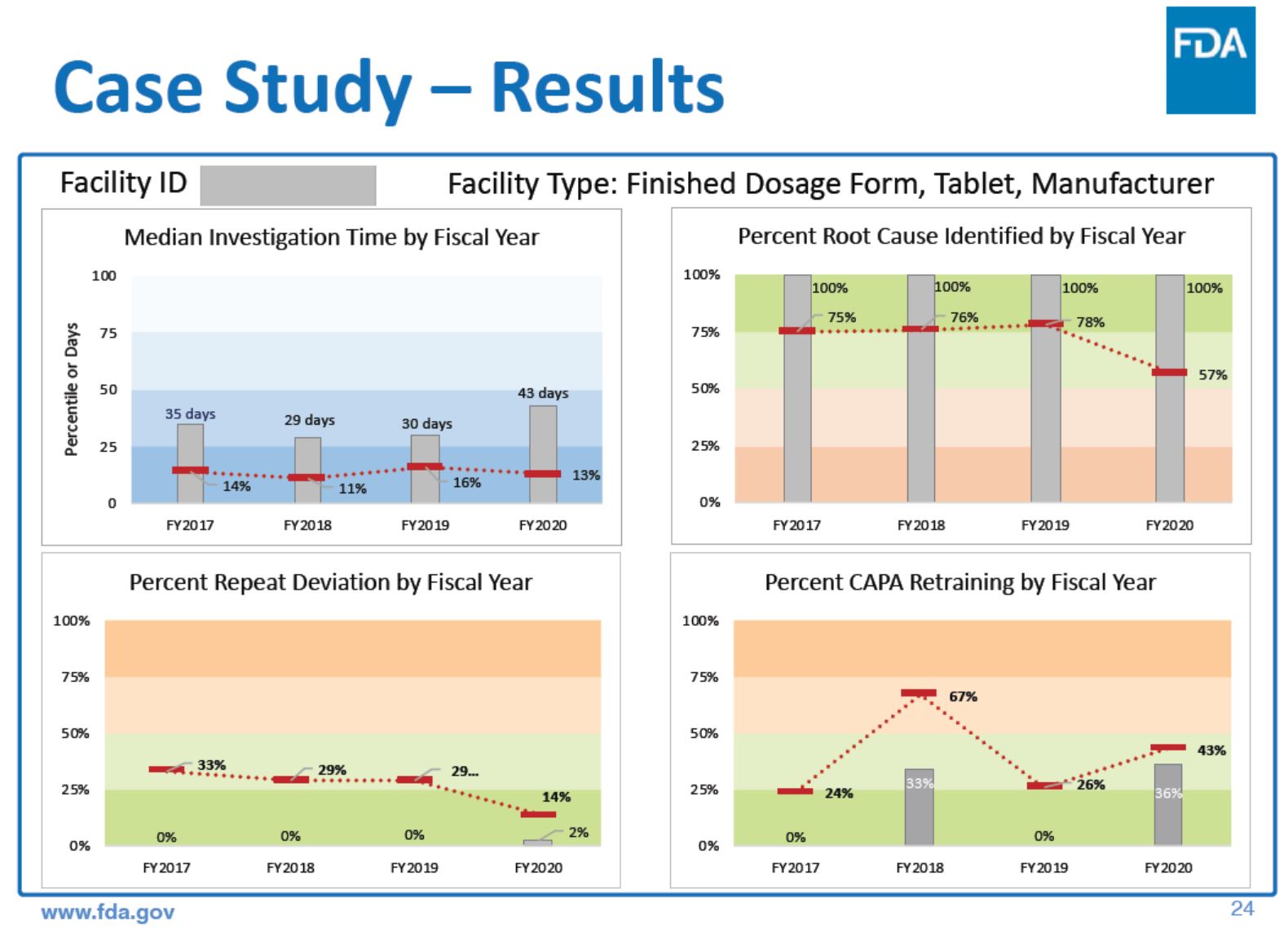
FDA 现场警示报告预测性分析试点,机器学习助力质量...
2020.04.15
美国 FDA 药品质量办公室(OPQ)下的质量监视办公室最近开展了一项预测性分析(Predictive Analytics)试点,使用现场警示报告(Field Alert Report, FAR)中的信息来衡量药品质量。给那些调查时间短并且能够发现不合格的根本原因的公司打高分,而给那些调查时间长并且无法找到不合...
|