
|
FDA 发布针对 81 种活性成分的 105 篇新增和修订 ...
2019.11.23
美国 FDA 于 11 月 21 日发布了针对 81 种药物成分的具体产品指南文件,以帮助仿制药开发。这是 2019 年 FDA 发布的第四批新增和修订具体产品 BE 指南文件,之前分别于 2 月份、5 月份和 9 月份发布过三批指南文件。
这 105 篇 BE 指南中包括 64 篇针对复杂药品...
|
|
FDA 发布透皮和局部递药系统研发和质量考量指南草案
2019.11.22
美国 FDA 于 11 月 20 日发布了《透皮和局部递药系统 – 产品研发和质量考量》指南草案,详细给出了新药和仿制药申请中应包括的透皮和局部递药系统(transdermal or topical delivery system, TDS)的药品研发和质量信息。
这份 28 页的指南草案解释了 FDA “关于产...
|

|
关于美国生物制药市场中知识转移的分析研究
2019.11.22
过去几十年中,知识一直被视为是与个人、公司、行业和经济的成功相关的关键资源。这种认识导致公司基于知识的观点(knowledge-based view, KBV)迅速兴起。这一观点的支持者认为,异构的知识库和能力是导致公司竞争优势和卓越绩效的主要驱动力,尤其是在高科技市场。KBV 认为公司存在...
|
|
FDA批准治疗成人部分发作性癫痫的新疗法
2019.11.21
For Immediate Release November 21, 2019
The U.S. Food and Drug Administration today approved XCOPRI (cenobamate tablets) to treat partial-onset seizures in adults.
“XCOPRI is a new option to treat adults with partial-onset seizures, which is an ...
|

|
与FDA副局长Mark Abdoo的对话:关于新的全球政策和战...
2019.11.21
A Conversation with FDA Associate Commissioner Mark Abdoo
Whether it is generic drugs from India, fruits and vegetables from Mexico, or life-saving medical devices from Europe, there’s a good chance these and other products Americans use every day...
|

|
FDA批准治疗慢性淋巴细胞白血病的新疗法
2019.11.21
【FDA在国际合作下采取第二项行动,批准治疗慢性淋巴细胞白血病的新疗法】
For Immediate Release November 21, 2019
Today, as part of Project Orbis, a collaboration with the Australian Therapeutic Goods Administration (TGA) and Health Canada, the U.S. Foo...
|
|
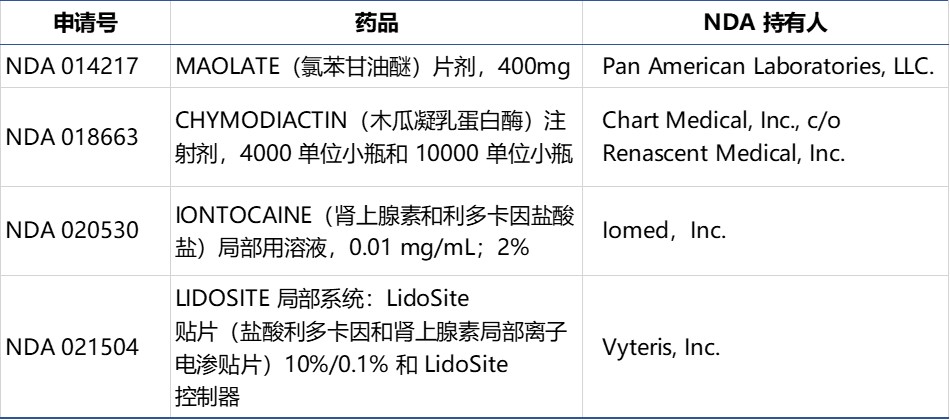
四件新药申请因未能提交年报而遭 FDA 撤销
2019.11.21
美国 FDA 于 11 月 15 日宣布计划撤销对 4 件新药申请(NDA)的批准,因为 NDA 持有人未能提交与之相关的年度报告。
年度报告旨在为 FDA 提供有关前一年可能会影响药物安全性、有效性或标签的更多信息。报告还必须简要描述申请人由于新信息而已采取或打算采取的行动,...
|
|
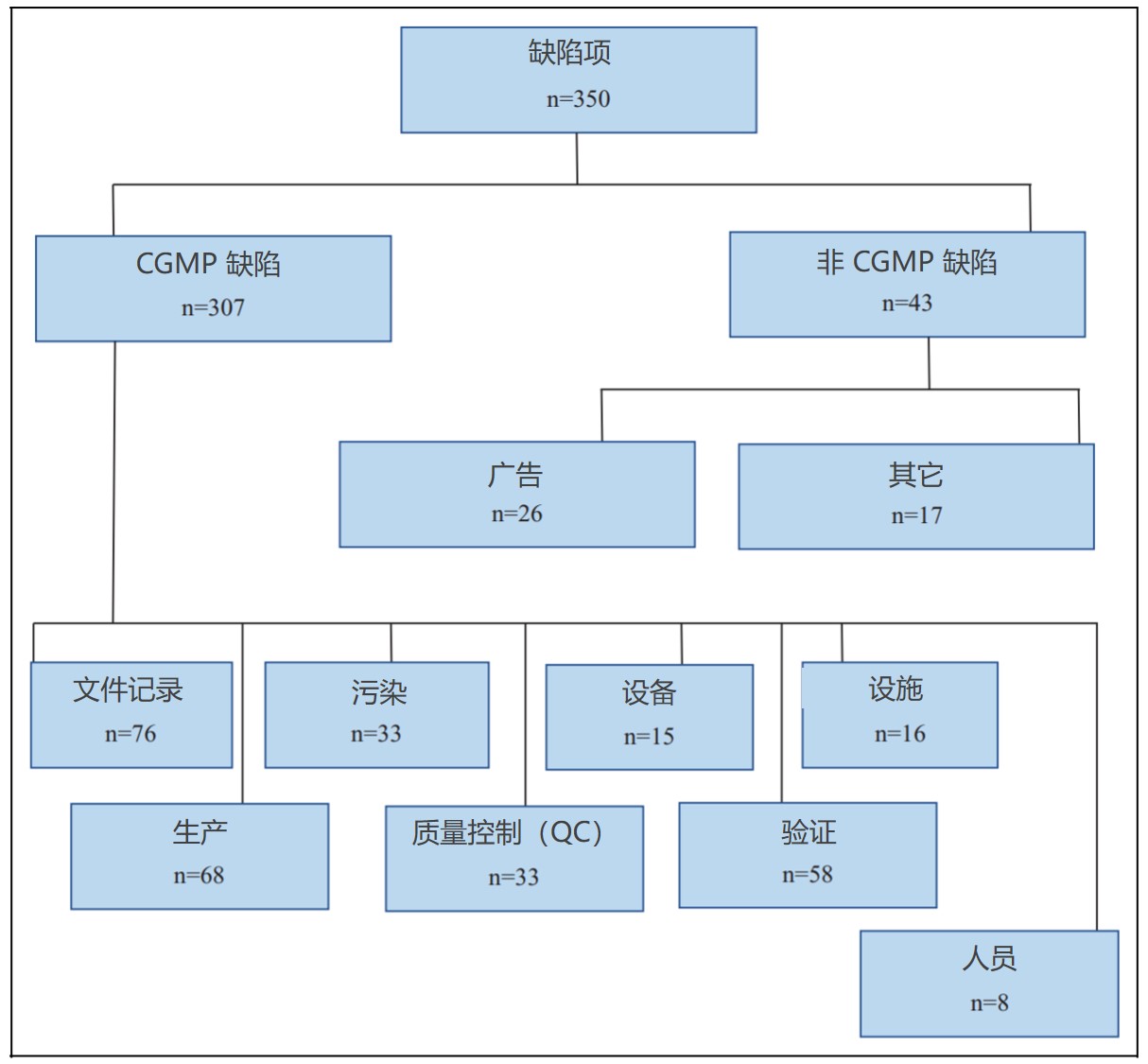
美国 FDA 向印度制药与器械企业发布的警告信分析
2019.11.21
在过去 14 年内,FDA 向印度制药和器械企业发出的警告信数量逐渐增多。在警告信列出的所有违规行为中,85.87% 与 CGMP 不合规有关。此外,在这些警告信中有 80.72% 在之后没有关闭函。
这一回顾性研究于 11 月 5 日发布于 DIA 《治疗创新与监管科学杂志》上,分析回顾了 20...
|

|
FDA批准首例治疗遗传性罕见病的疗法
2019.11.20
For Immediate Release November 20, 2019
Today, the U.S. Food and Drug Administration granted approval to Givlaari (givosiran) for the treatment of adult patients with acute hepatic porphyria【FDA批准Givosiran治疗急性肝卟啉症】, a genetic disorder res...
|
|
FDA批准Givosiran治疗急性肝卟啉症
2019.11.20
On November 20, 2019, the Food and Drug Administration approved givosiran (GIVLAARI, Alnylam Pharmaceuticals, Inc.) for adults with acute hepatic porphyria (AHP)【FDA批准首例治疗遗传性罕见病的疗法】
Efficacy was evaluated in ENVISION (NCT03338816)...
|

|
“隐藏设施”成 FDA 仿制药申请受阻的主要缺陷之一
2019.11.20
美国 FDA 表示,阻碍仿制药申请审评的一个主要缺陷是存在“隐藏设施”,即,II 类药物主文件(DMF)中列有某些设施,但在相关联的简化新药申请(ANDA)中却没有列出这些设施。有 16% 的 ANDA 存在这一问题。
11 月 4 日在普享药协会(AAM)举办的 GRx-Biosims 会议上,FDA...
|
|
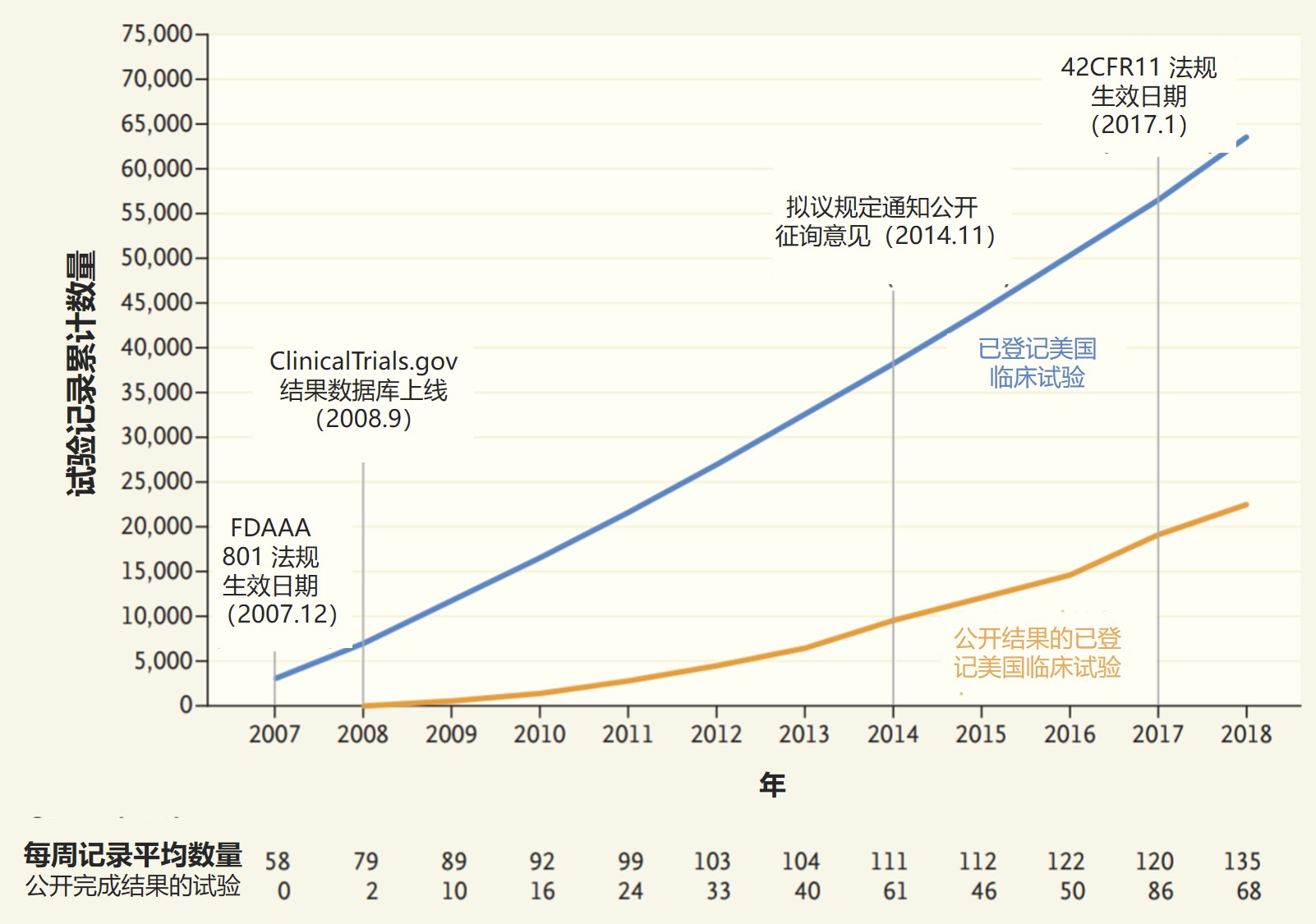
更多临床试验结果得到公开,但数据质量欠佳
2019.11.19
最新一项研究审查了在 ClinicalTrials.gov上报告研究结果的第一个十年的数据,研究显示制药公司和学术研究中心在报告人体研究结果方面取得了缓慢进展,但是数据质量可能仍存在更大的问题。这一研究于 11 月 14 日发表在《新英格兰医学杂志上》。
研究指出,数据库通过 2008 年...
|

|
2500 万美元:Dr. Reddys 召回雷尼替丁的代价
2019.11.19
在发现雷尼替丁中潜在致癌物亚硝胺含量超出可接受水平后,最近许多仿制药商从美国市场召回了他们的雷尼替丁产品。根据仿制药商之一 Dr. Reddy's 的财务报告显示,召回的财务打击并不小。
虽然其他制药商没有报告召回成本,但印度 Dr. Reddy's 很好地说明了必须花多少钱来弥补其...
|

|
FDA 批准首款可减缓儿童近视进展的隐形眼镜
2019.11.18
美国 FDA 于 11 月 15 日批准了首款可在开始治疗时减缓 8 至 12 岁儿童近视进展的隐形眼镜。这款隐形眼镜名为 MiSight,为一次性使用,用后即抛的软性隐形眼镜,在每天晚上睡前丢弃,不建议配戴过夜。
FDA 器械与放射健康中心(CDRH)眼科、麻醉、呼吸、耳鼻喉科和牙科办公室主任 ...
|

|
【更新提示】识林一周回顾(20191110-1116)
2019.11.17
【CFDI】公开征求《疫苗生产现场检查指南》(征求意见稿)的意见(11.13)
为指导检查员对疫苗生产企业的生产现场检查,制定本指南,作为疫苗生产现场检查基础性技术指导文件。检查员可参照本指南的要求,对企业的生产和质量管理进行检查。检查过程中,检查员应依据《药品生产质量管理...
|
|
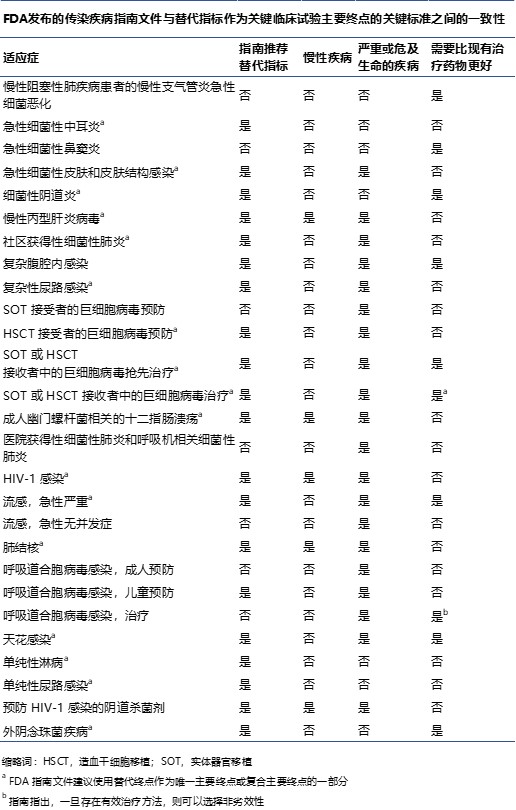
研究人员呼吁 FDA 重新考虑允许使用替代终点的指南
2019.11.16
哈佛大学和乔治华盛顿大学医学院的研究人员于 11 月 12 日在《美国医学会杂志内科学》上发表的一篇评论中指出,美国 FDA 需要在有关开发传染病治疗方法的一些指南文件中重新考虑替代结果的使用。
该评论文章评估了 22 份 FDA 发布的指南文件,包括针对 27 中疾病适应症的关...
|

|
ICH 2019-2020 年指南制定进展更新
2019.11.15
11 月 4 日,加拿大卫生部和美国 FDA 在加拿大渥太华举行 ICH 联合公开咨询会议,两个机构的官员概述了在本月晚些时候即将举行的 ICH 新加坡会议之前 ICH 一些指南所取得的进展。
六个月前,FDA 曾主持了类似的与加拿大的联合公开咨询会议,简要介绍了十几份不同 ICH 指南的...
|
|
WHO 启动人胰岛素预认证试点程序
2019.11.15
近年来,许多生物治疗产品(BTP)在治疗许多威胁生命的慢性疾病方面已取得成功。2014 年 5 月世界卫生大会(WHA)通过了关于“获取生物治疗产品,包括生物类似治疗产品,并确保其质量、安全性和有效性”的 WHA67.21 号决议。
BTP 是高度复杂的生物药,在某些国家中,根据国际认...
|
|
FDA批准治疗复杂性尿路感染的新抗菌药物
2019.11.14
FDA approves new antibacterial drug to treat complicated urinary tract infections as part of ongoing efforts to address antimicrobial resistance
FDA批准治疗复杂性尿路感染的新抗菌药物,是解决抗菌素耐药性持续努力的一部分
For Immediate Release November 14,...
|

|
FDA批准治疗复发性和难治性套细胞淋巴瘤患者的疗法
2019.11.14
FDA批准治疗复发性和难治性套细胞淋巴瘤患者的疗法,临床试验结果显示肿瘤缩小反应率高
For Immediate Release November 14, 2019
Today, the U.S. Food and Drug Administration granted accelerated approval to Brukinsa (zanubrutinib) capsules for the treatment of a...
|