
|
FDA 向 IPEM 师生讲座
2019.09.28
9月24日,在FDA驻华办助理主任Lane Christensen和项目协调员王倩(她同时也是IPEM 2011级学员)的带领下,FDA一行与百余名IPEM师生在北京美丽的秋色中再次相聚。CDER合规办公室下属生产质量办公室(Office of Manufacturing Quality,OMQ)主任Francis Godwin先生,项目和监管运行...
|

|
FDA 与 IPEM 师生趣谈十年成就
2019.09.28
9月24日上午,FDA与IPEM师生和代表内部交流活动中,北京大学郑强教授代表师生抛出的最后一问:FDA合规监管过去十年最大成就是什么? CDER药品质量办公室下属警戒办公室质量情报、风险分析和建模处主任 Jennifer Maguire打趣说:“最大的成就是雇佣了我”,引起了一番趣谈。
(一...
|

|
不再透明?FDA不顾反对力求减少审评报告公开信息
2019.09.27
美国 FDA 新药办公室(OND)主任 Peter Stein 在 9 月 24 日下午的 RAPS 监管趋同闭幕会上, 向与会人员确认,申办人和其他感兴趣的利益相关方如果希望检索一些当前在 FDA 发布的药品批准文件包中可获得的数据,在新的综合审评(integrated review)计划下将需要通过信息自由法...
|

|
FDA 公布诺华对数据操纵问题的 483 回复
2019.09.26
美国 FDA 于 9 月 24 日公布了 诺华公司在 8 月 23 日提交给 FDA 的有关其基因治疗药数据操纵问题的 483 回复。这份长达 59 页的回复函中指出,由于调查的“高度复杂”性而未能尽快将这一问题告知 FDA,并将问题责任归咎于两名 AveXis 高管。
诺华下属子公司 AveXis 公司...
|
|
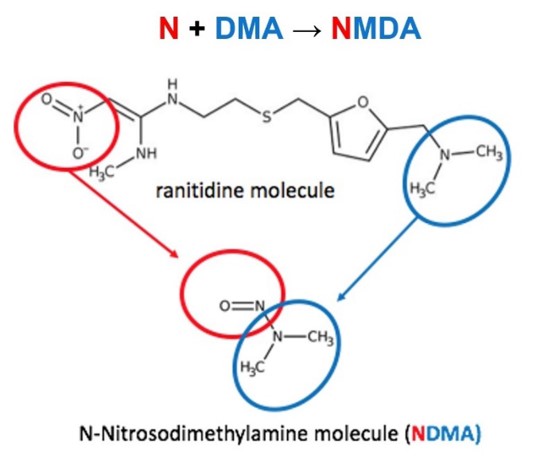
雷尼替丁因含 NDMA 在多国被禁,不只是杂质污染那么...
2019.09.25
到目前为止,世界范围内有十几个国家正在采取行动,限制或禁止销售含有潜在致突变杂质 N-亚硝基二甲胺(NDMA)的雷尼替丁,包括赛诺菲公司生产的品牌药 Zantac(善胃得)。有机构提出,由于其不稳定性,雷尼替丁药物本身或成为一种潜在致癌物。
NDMA 等亚硝胺类杂质因去年夏天在沙...
|

|
FDA 总结 2019 财年警告信四大趋势
2019.09.24
美国 FDA 生产质量办公室副主任 Rick Friedman 于 9 月 16 日在华盛顿举行的 PDA/FDA 联席监管会议上,对 2019 财年最新 GMP 违规导致的警告信发布情况做了通报,并通过最近一些警告信来举例说明了检查员发现的一些缺陷项。
本财年到目前为止生产质量办公室已发布 89 封...
|

|
FDA 两大中心主任讨论如何克服生物制造创新障碍
2019.09.23
美国 FDA 生物制品中心(CBER)主任 Peter Marks 和药品中心(CDER)主任 Janet Woodcock 在今年 6 月下旬国家生物制药制造创新研究所(NIIMBL)第三次年会上分别做了报告,讨论了制药业制造创新方面的现状与面临的挑战以及如何克服障碍。
Marks 提出,公私合作在推进细胞和基因治疗...
|

|
【周末杂谈】为信息技术鸣冤
2019.09.22
“新上的信息系统太差了,老出错”,“这个软件太笨了,还不如我手工做”。这样的话可能大家常听到。
多年前,在我开始学计算机编程时,导师对我说“没有笨的计算机程序,只有笨的编程人员”。道理简单,信息系统是按程序员事先设计编写好的程序行事。它不会犯错,因为它只是忠实地执行...
|

|
【更新提示】识林一周回顾(20190915-0921)
2019.09.22
【IPEM】2019年IPEM课程教育9月份下旬课程即将在北京开班
课程安排如下:
9 月 21-22 日,新药和改良型新药的临床审评、沟通机制、常见问题分析,授课老师:唐健元、陈晓媛;
9 月 23-24 日,FDA 法规政策更新、注册申报要点、与审评人员的有效沟通,授课老师:杨永胜;
9...
|

|
FDA 推出技术现代化行动计划,向“云”监管转型
2019.09.21
美国 FDA 于 9 月 18 日公布了其技术现代化行动计划(Technology Modernization Action Plan,TMAP),这是其为海量数据申请持续增长做准备并帮助填补科学进步和新疗法之间差距的努力的一部分。
计算机硬件和软件技术的近期现代化是 FDA TMAP 的重点,提供了关于 FDA 需...
|

|
EDQM发布人用组织和细胞的质量和安全性新指南 2019092...
2019.09.21
The EDQM has just released the new edition of its Guide to the quality and safety of tissues and cells for human application. This 4th edition provides healthcare professionals with an extensive overview of the most recent advances in the field, as we...
|
|
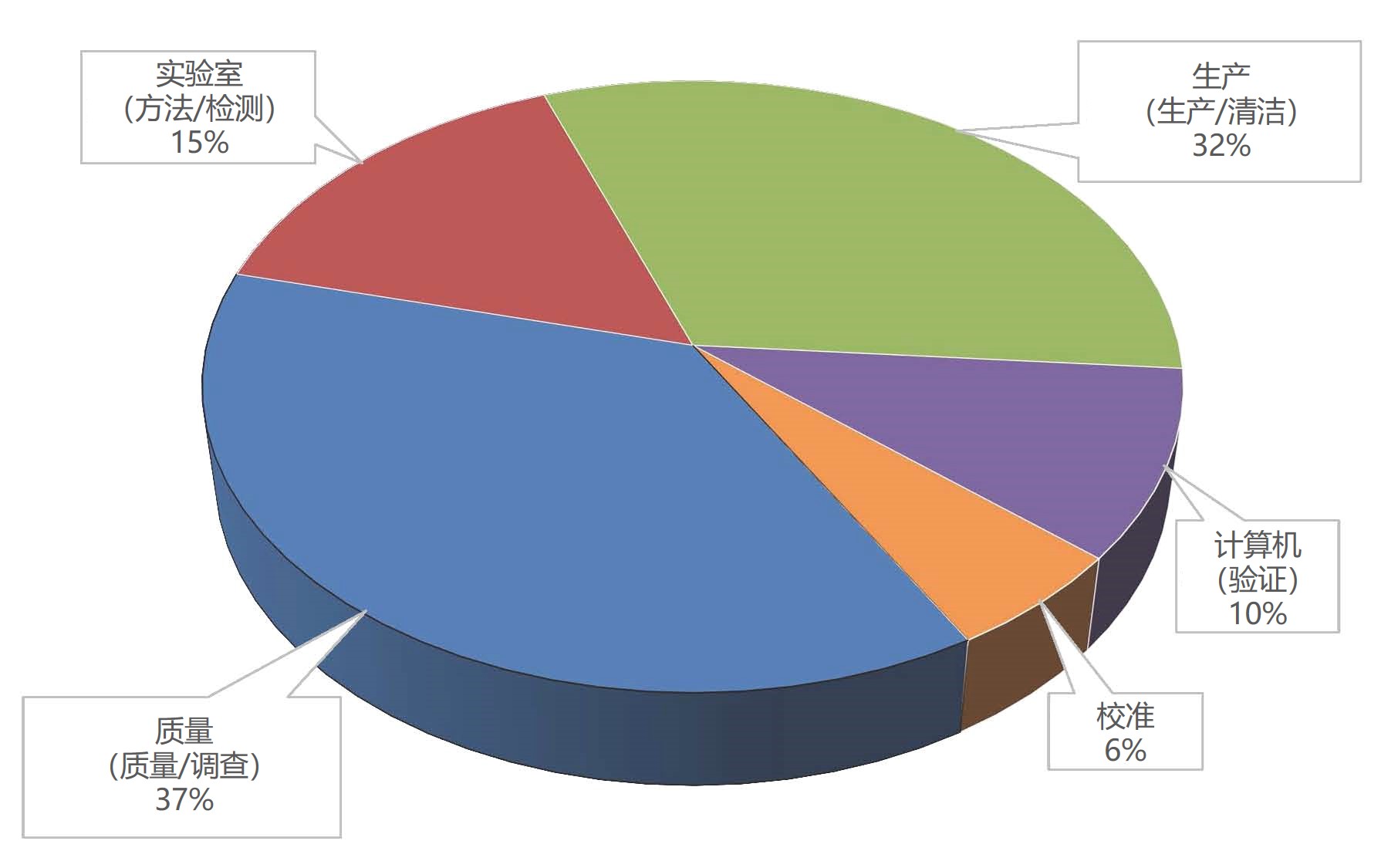
FDA点评2018财年十大引证项,数据可靠性和质量文化仍...
2019.09.20
美国 FDA 监督消费者安全办公室的官员 Dell Moller在今年三月份的 FDA/Xavier PharmaLink 会议上报告了 FDA 2018 财年十大最常见药品 GMP 检查引证项。本文总结了 Moller 幻灯片中 FDA 对各引证项的简要分析,以及 Moller 与 FDA 专家组成员 FDA 药品质量运营办公室(OPQO)3...
|

|
FDA 阻止故意拖延仿制药批准的公民请愿指南定稿
2019.09.20
美国 FDA 于 9 月 18 日发布了《根据联邦食品、药品和化妆品法案第 505(q)节规定的公民请愿和中止行动请愿》定稿指南,指南讨论了 FDA 在确定公民请愿(citizen petition)和中止 FDA 行动的请愿其主要目的是否是推迟未决仿制药(ANDA,505(j))、生物类似药(351(k))或改良...
|
|
欧洲药典更新反映监管和科学进步
2019.09.19
欧洲药典(PhEur)第 10 版于今年 7 月发布,更新反映了欧洲和国际层面的监管变化以及最新的科学和技术进步,以及对仿制药和生物类似药不断增长的需求。在最新版欧洲药典的 114 篇新增各论中,有多篇生物制品各论,包括英夫利昔单抗和通过 rDNA 技术生产的其它药物。还有 17 篇...
|
|
在与澳大利亚和加拿大的新国际合作中FDA首次采取行动...
2019.09.18
FDA takes first action under new international collaboration with Australia and Canada designed to provide a framework for concurrent review of cancer therapies, approving treatment for patients with endometrial carcinoma
For Immediate Release Septemb...
|

|
Project Orbis---FDA与多国合作加速肿瘤药物审批
2019.09.18
Project Orbis, an initiative of the FDA Oncology Center of Excellence (OCE), provides a framework for concurrent submission and review of oncology products among international partners.
Collaboration among international regulators may allow patients wi...
|
|
FDA - TCPro 工具模拟生物治疗药物免疫应答
2019.09.18
Scientists at the U.S. Food and Drug Administration (FDA) have developed a mathematical tool that predicts whether the body will produce antibodies that block the activity of biotherapeutic protein drugs.
The computational tool, called TCPro, simula...
|

|
FDA 发布 34 篇新 BE 指南和 19 篇修订指南
2019.09.18
美国 FDA 于 9 月 16 日发布了一批 53 篇具体产品生物等效性(BE)指南,其中 34 篇新增,19 篇修订。
这些指南中包括针对复杂药品的 5 篇新增指南草案和 11 篇修订指南草案。53 篇指南中近半数(8 篇复杂药品和 18 篇非复杂药品)针对的是尚无获批简化新药申请(ANDA)的...
|
|
普渡制药因面临阿片类药物广泛巨额诉讼申请破产
2019.09.17
由于面临成千上万有关煽动阿片类药物成瘾危机的指控,美国普渡制药(Purdue Pharma)于 9 月 15 日宣布已申请破产,标志着这家因出售其阿片类止痛药奥施康定(OxyContin)及其它药物而攫取了数十亿美元利润的公司倾覆在即。
破产是普渡制药与美国普渡制药与 24 个州和数千个县市...
|

|
欧盟制药业质疑 ICH 生物分析方法验证指南
2019.09.16
欧盟的制药企业对于今年 2 月份新发布的 ICH M10《生物样本分析方法验证指南》提出质疑,认为指南“过于宽泛且含糊不清”,如果不做出改变,所有研究、基质和分析物都可能被包含在指南范围之内,给企业增加负担。
欧洲制药工业协会联合会(EFPIA)在 8 月 23 日提交到欧洲药品管理...
|