
|
美国国会质疑FDA保护机密信息的能力
2016.07.12
在对前FDA官员新的内幕交易指控曝光之后,美国国会正在向FDA施压,要求FDA证明对机密信息的保护。
6月24日,众议院能源与商务委员会主席Fred Upton和健康小组委员会主席Joseph Pitts致函。尽管询问的仅是食品部分,但FDA的回复适用于其监管的所有行业。
Upton和Pitt二月份的信函是...
|
|
FDA参照药品撤市后仿制药标签变更指南草案
2016.07.11
7月8日美国FDA发布《参照药品撤市后ANDA标签更新》指南草案。描述了FDA在这种情形下预期ANDA申请人如何应对以及做出何种类型的变更。
FDA在指南中明确表示,该指南对FDA仿制药拟议标签规定不具有适用性,但表示,该指南提供了FDA对ANDA申请人在特定情况下是在FDA的指导下还是在之前已获...
|

|
FDA发布两份基于下一代基因测序技术的检测的指南草案
2016.07.10
为支持总统精准医疗倡议,美国FDA于7月6日发布了两份关于发布了两份下一代测序技术(NGS)检测的指南草案,这两份指南定稿后,将为医学上检测个人基因组构成的重要差异的诊断监管提供灵活和精简的方法。
NGS技术可以扫描人体DNA,以检测可以决定一个人是否患有疾病或处于疾病的风险中的...
|

|
数据可靠性案例情景剧
2016.07.09
这是一个真实案例。
【背景】
公司是做药物洗脱支架,用于动脉壁,是钛材料做的,插到动脉壁之后血管壁会扩张,但因为是金属材料,会产生排异反应,所以需要药品材料外壁以保证金属材料不直接与血管壁接触,最外层是一层薄薄的聚合材料。在人体中需要3个月的时间释放。
【人物】
...
|

|
FDA项目整合计划:更多问题有待回答
2016.07.08
我们在之前的资讯中曾详细介绍过FDA项目整合小组(Program Alignment Group, PAG)计划的背景和目标【识林资讯 - FDA新检查计划之项目整合小组计划】以及FDA器械人员对该计划的评论【识林资讯 - FDA 监管事务办公室检查项目整合计划正在酝酿巨大变革】。2014年2月时任FDA局长的Margare...
|

|
FDA发布顾问委员会利益冲突“显现”指南草案
2016.07.07
美国FDA表示咨询委员会中的利益冲突显现问题举足轻重。根据联邦利益冲突法不构成回避义务的利益和关系,但可能造成成员缺乏公正性的显现,即显现问题(appearance issues)。
6月26日,FDA首次发布指南草案详细说明了当利益冲突显现可能妨碍某人继续在专家咨询小组服务时的情况。到目...
|

|
EMA总部新址将由成员国协商决定
2016.07.07
7月6日欧洲药品管理局(EMA)发表声明表示,EMA将不会决定将伦敦总部搬迁到哪里,而将会由成员国代表之间通过共同协商决定。
EMA在声明中表示,“EMA欢迎一些会员国表达出未来接纳EMA总部的兴趣。EMA所在地的决定将不会由EMA做出,而是将会由成员国代表之间通过共同协商决定。考虑到英...
|
|
FDA可能会对预充式注射器组合产品发布更多缺陷函
2016.07.06
带有无针预充式玻璃注射器和连接装置的组合仿制药的提交可能会受到缺陷信的冲击。Sandoz公司政策和监管策略负责人Nicholas Tantillo在5月17日仿制药协会CMC研讨会上断言,预充式注射器的器械连接问题可能成为在某些药械组合简化新药申请(ANDA)审评期间新的“常见缺陷”。
在一系列不...
|
|
元素杂质要求在欧美的实施时间
2016.07.05
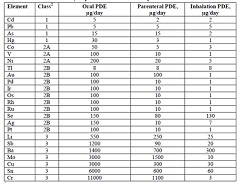
ICH Q3D元素杂质指导原则,适用于化药的元素杂质要求,不适用于植物药、放射药、血浆衍生物、透析液等。
ICH Q3D列出了24种元素杂质的PDE标准(每日允许暴露量)。Q3D 给出了每个元素,如何进行的毒性分析,如何确定的PDE值。并且按照不同途径的毒性试验结果,计算得出不同途径(口服...
|
|
半年之内FDA再次修订帕利哌酮长效注射剂BE指南
2016.07.05
我们之前曾报道过FDA于2015年12月发布对用于肌肉注射的棕榈酸帕利哌酮长效注射剂混悬液生物等效性指南(BE)的修订【识林资讯-FDA修订帕利哌酮长效注射剂BE指南】。FDA于今年6月又发布了另一修订版本(2016年6月修订版草案)。
我们注意到有一些有趣的变化。之前我们介绍过2015年12...
|

|
依维莫司片两个不同BE指南的警示
2016.07.04
2016年6月最近更新的具体产品的生物等效性(BE)指南中,有一篇关于依维莫司(Everolimus)的BE指南(RLD 021560),该指南涵盖了治疗器官排斥反应中的药物使用。之前的指南文件(2011年3月首次发布,2012年6月修订)适用于肿瘤适应症的不同产品(RLD 022334)。
两个指南文件都提...
|
|
印度计划改写已有75年历史的药品法
2016.07.03
印度撤销了对其药品法的修订提案,决定需要更广泛地改写药品法,以有效监管生物制品、干细胞和再生医学、医疗器械,以及临床试验。
起初,印度政府计划用2013年提出的修正案更新1940年药品和化妆品法。然而,6月22日莫迪总理表示,联邦内阁已经放弃了这一想法,取而代之的是更广泛的修...
|

|
欧盟医疗器械和IVD法规重大修订
2016.07.01
2016年6月15日,在欧盟委员会的支持下,欧洲理事会常驻代表委员会和欧洲议会环境委员会签署了关于医疗器械的两项新规。新规在理事会、议会和委员会之间历经四年的讨论和谈判,代表了目前欧盟法规的重大修订。在很多方面,法规将更加严格,要求更强,监测更多。
医疗器械和IVD器械企业的...
|

|
FDA局长:FDA是科学和科学家们的伟大殿堂
2016.07.01
【编者按】有人说FDA才是药业科技创新的主要推手。从局长文章字里行间中对科学和科学家们的尊重上看,这个推手大概非FDA莫属了。
(译自FDA Voice “FDA A Great Place for Science…and for Scientists on the New Frontier of Regulatory Science” 2016年6月23日,作者:R...
|
|
生物类似药收费II期:FDA和业界达成一致
2016.06.30
美国FDA和生物技术产业代表在经历了从3月到5月的14次会议之后就生物类似药使用者付费法案II期(BsUFA II)达成一致。具体而言,双方已确定了承诺函草案,这代表了开始于2015年12月的谈判过程所达成的协议。
与FDA其它使用者付费计划类似,BsUFA是FDA和利益攸关方达成的一个五年协议,...
|

|
国际仿制药和生物类似药协会加入ICH
2016.06.29
2016年6月15日,国际协调理事会(ICH)(前身为国际协调会议)宣布,国际仿制药和生物类似药协会(IGBA)作为会员加入ICH。这是代表仿制药和生物类似药企业的组织首次与监管机构和传统上在创新领域的制药企业坐在一起。
据报道,欧洲药品(Medicines for Europe,前身是欧洲仿制药协...
|

|
六位FDA前任局长一致呼吁:FDA成为独立内阁机构
2016.06.28
编者按 与美国相比,至少在这一点上,中国启步晚,但走得快。
日前,六位FDA前任局长一致呼吁:让FDA成为一家独立机构,提升其地位。这六位前任局长领导FDA的时间,加起来达32年之久。
FDA目前是美国卫生与人类服务部(HHS)的下属机构。这六位前任局长主张,让FDA成为一个内...
|

|
MHRA考虑退欧影响,BSI仍将作为欧盟认证机构
2016.06.27
英国药品和卫生产品监管机构(MHRA)周一表示仍在努力了解国家脱离欧洲后的全部后果。“在英国脱离欧洲的公投结果出来后,药品和卫生产品监管机构的工作重点一直是公共健康。我们将继续与支持我们的客户、合作伙伴和利益攸关方合作保护健康和改善生活,努力达到最高水平的卓越和质量”MHRA...
|

|
【研讨会】数据管理的监管要求和企业动力
2016.06.26
数据管理的监管要求和企业动力 — 2016年IPEM毕业典礼专题报告会
Data Management:Regulatory Requirement and Industry Motivation — The IPEM Graduation Symposium
时间:2016年7月8日(周五)Friday July 8, 2016
地点:北京大学中关新园1号楼 科学报告厅 Sciences Au...
|

|
FDA Para IV 清单更新四个产品
2016.06.26
6月21日仿制药办公室(OGD)更新了第IV段声明数据库(Paragraph IV数据库,PIVDB)pdf。该数据库列出了首次提交并取得第IV段声明的产品,即ANDA所根据的参照产品的至少一个专利在其ANDA递交中不被侵犯或无效或无法执行。这一数据库旨在为预期的ANDA申请人提供专利保护品种的第一份ANDA何...
|