|
首页
>
资讯
>
FDA仿制药使用者付费进展报告
出自识林
2015-02-15 FDA Law Blog
2015年2月9-11日在迈阿密召开的仿制药协会(GPhA)年会上,仿制药办公室(OGD)主任Kathleen “Cook” Uhl博士在她的仿制药使用者付费修正案(GDUFA)进展报告 中所传递的信息十分明确:虽然任重道远,但OGD工作正有所进展。 当然“眼见为实”,让我们具体来看一看。 中所传递的信息十分明确:虽然任重道远,但OGD工作正有所进展。 当然“眼见为实”,让我们具体来看一看。
我们现在已处在2015财年的第二季度,2015财年同样也是GDUFA申请队列的第3年。对于这个申请队列,FDA承诺15个月内对60%的原始ANDA审评并采取行动(绩效目标在2016财年[GDUFA第4年]逐渐升高至15个月对75%原始ANDA采取行动,在2017财年[GDUFA第5年]调高为10个月内对90%的原始ANDA采取行动)。GDUFA也涵盖了2015财年其他方面的绩效目标,包括对已获批申请的补充申请(PAS)和受控函(Controlled Correspondence)的相关目标。
尽管我们离第一个对原始ANDA的15个月GDUFA目标的截止日期还很远(即2015年10月- 译者注),但很明显OGD在努力构建审评体系以确保能完成目标(这里所指的达成目标,是ANDA批准,而不是签发完全回应函)。例如,OGD已超额完成了GDUFA招聘目标(下面Uhl博士幻灯片中的表格有所展示)、增强办公室的信息技术系统以在各方面提高效率、大幅调整了办公室的架构、联合必要的其它FDA部门建立成功(且迅捷的)ANDA审评系统、以及发布大量指南文件、政策和程序手册。
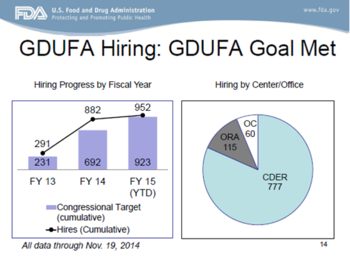
正如下方Uhl博士幻灯片中展示的那样,迄今为止,对于GDUFA第三年队列中以及其他在2015财年目标约束下的申请,OGD的工作已颇有成效。

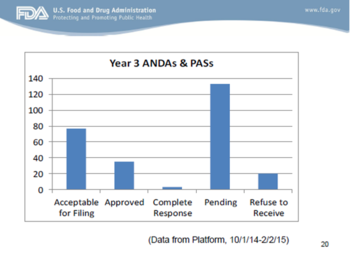
以上幻灯片中有两点值得我们注意:(1) FDA初始审评和ANDA接收的平均时间低于30天(确切地说,是27天);(2) 还仍有大量的ANDA收到了拒绝接收(RTR)函。后一点应该是大家通过一点努力就能够克服的。FDA发出的大多数RTR函是由于GDUFA缴费不全或不正确、稳定性数据、溶出数据或生物等效性数据不全(甚至是研究失败)、以及对于微小缺陷沟通的回复不完整或不按时。
尽管OGD似乎确实对GDUFA第三年的申请取得了进展,但OGD对于GDUFA前以及GDUFA头两年(2013财年和2014财年)所提交申请的“搬运”能力,还仍在进行之中,并且是仿制药业界持续担忧的问题。(GDUFA头两年,即2013及2014财年,这两年提交的申请没有任何审评绩效目标约束,故被称做“GDUFA甜甜圈空洞”-译者注)
为了给读者们一个直观的印象,下面几张幻灯片显示了GDUFA前以及“甜甜圈空洞”中需要OGD“搬运”的货物,Uhl博士展示了相当多的ANDA申请数据。
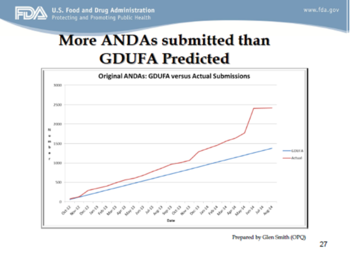
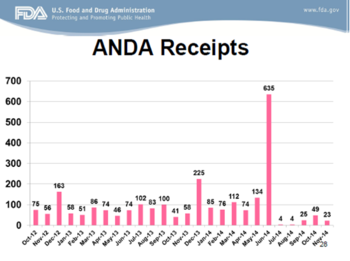

下面两张幻灯片展示了OGD正有所进展,但显然还有许多工作要做。


OGD将如何保持负责任的形象并平息业界的担忧?(这种担忧在FDA最近的预算发布后又不断强烈 - 财政预算 第65页显示2014财年的ANDA批准时间中位数为42个月并对于以后两年的预测都保持42个月不变)。答案似乎就是:为GDUFA第三年前的申请设立“目标行动日期”(TAD, Target Action Dates) 第65页显示2014财年的ANDA批准时间中位数为42个月并对于以后两年的预测都保持42个月不变)。答案似乎就是:为GDUFA第三年前的申请设立“目标行动日期”(TAD, Target Action Dates)
TAD是OGD最近创设的,对一些ANDA分配TAD已经有几个月了,而现在更像是为达成GDUFA目标的一次演习。 TAD并不是GDUFA目标日期,更像是OGD内部对于申请的行动时限。 在GPhA年会上,Uhl博士声明OGD将会把TAD倡议扩大到所有的GDUFA第三年前的申请上,并向ANDA的申请者通报分配的TAD。OGD将会在接下来的几个月中扩展TAD的倡议,详细的讨论见如下两张幻灯片。


原文请见
We Need to Move the Freight and Not be Late, Says OGD's Uhl in GDUFA Update; But for Many in Industry, "Seeing is Believing"
Kathleen Uhl博士幻灯片
|