
|
七名前 FDA 局长联名呼吁美国政府停止对 FDA 信誉...
2020.10.02
继半个月前八名 FDA 现职专业负责人联名发表声明承诺基于科学的决策之后【FDA 专业负责人联名承诺:科学至上】,七名前任 FDA 局长于 9 月 29 日在《华盛顿邮报》的观点文章1中联名呼吁停止政府对 FDA 信誉的破坏。科学家应根据数据做出决策,不受政治压力或意识形态或既得利益...
|
|
首个新冠疫苗获批后,其它试验如何维持安慰剂对照?
2020.09.22
美国 FDA 官员正在考虑如何确保即使在一款新冠疫苗成功获得监管许可后,仍然可以继续进行针对新冠疫苗候选者的随机、安慰剂对照 III 期临床试验。一旦 FDA 批准或紧急使用授权了新冠疫苗,试验受试者的招募可能会变得更加困难,已经入组的受试者可能希望退出试验转而接受已被证明有...
|
|
FDA 拟发布新冠疫苗紧急使用授权指南,或将要求更多...
2020.09.12
美国 FDA 生物制品审评与研究中心主任 Peter Marks 表示,FDA 可能会采用紧急使用授权(EUA)途径许可新冠疫苗,但全面许可通常会有更严格的安全性和有效性标准。
在 9 月 10 日 Duke-Margolis 卫生政策中心关于 COVID-19 疫苗接种的安全和有效性网络会议上,Marks 将这...
|
|
阿斯利康新冠疫苗试验暂停原因披露,且并非第一次试验...
2020.09.10
昨日医药领域最为引发热议的新闻之一恐怕就是阿斯利康/牛津大学 COVID-19 疫苗的 3 期试验因一名参与者出现与疫苗接种相关的疑似严重不良反应而暂停。现在事件又有了最新进展,我们一起来看看。
根据 STAT NEWS 的消息,阿斯利康首席执行官 Pascal Soriot 在美国时间周三上...
|
|
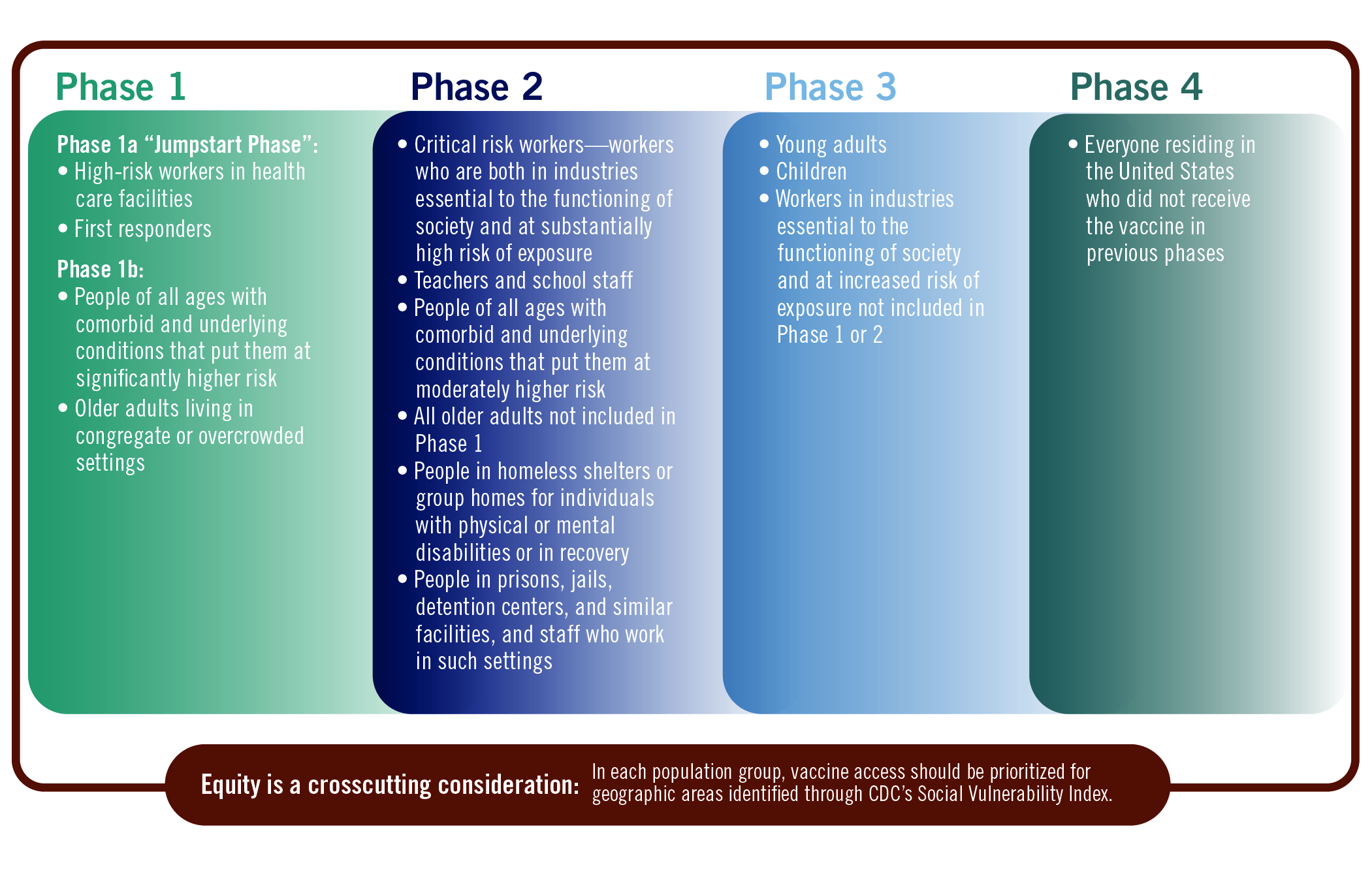
美国科学院发布 COVID-19 疫苗优先接种建议草案
2020.09.02
9 月 1 日,美国国家科学、工程和医学研究院发布了一份讨论哪些群体应优先接种 COVID-19 疫苗的报告草案,对于接种人群的优先级给出了详细建议。
报告题目为“公平分配 COVID-19 疫苗的初步框架讨论草案”,长达 114 页,由国家卫生研究院院长 Francis Collins 和美国疾控中心(C...
|

|
美国国家研究所牵头研究 COVID-19 疫苗制造问题
2020.08.13
美国国家生物制药制造创新研究所(NIIMBL)于 7 月 28 日举办网络研讨会,会上目前新冠(COVID-19)疫苗研发的几大主要参与者探讨了疫苗制造技术问题以及 NIIMBL 可以帮助解决的方面。
为保护人们免受 COVID-19 感染,疫苗制造商将重点放在尽快生产疫苗上,但是针对速度的优...
|
|
FDA 局长和主任联合发文增强公众对新冠疫苗的信心
2020.08.12
为打消公众对于新冠(COVID-19)疫苗的担忧,增强疫苗的信心,美国 FDA 局长、副局长和生物制品中心主任联合撰文,向公众解释和保证对 COVID-19 疫苗的严格监管。
FDA 局长 Stephen Hahn 医学博士、生物制品审评与研究中心(CBER)主任 Peter Marks 医学博士和 FDA 副局长 Ana...
|
|
Moderna 疫苗III期入组标准惹争议,FDA 将开展实时...
2020.07.29
美国 Moderna 公司于 7 月 27 日宣布启动针对其 COVID-19 候选疫苗的关键性 III 期试验,入组标准将排除已知新冠感染史者,引发专家疑问。当天 FDA 局长 Stephen Hahn 表示,FDA 将对 Moderna 公司的候选疫苗执行实时评价机制,实时审评从开始 III 期试验的当天开始...
|

|
美国政府与辉瑞达成疫苗最大订单,为新冠疫苗价格定下...
2020.07.24
7 月 22 日,美国政府与辉瑞公司和 BioNTech 美国公司签订了 19.5 亿美元的疫苗购买合同,这是迄今为止美国政府宣布的最高疫苗合同金额。
根据宣布的协议,美国卫生部(HHS)的生物医学高级研究与发展局(BARDA)和国防部将在辉瑞成功制造并获得批准或紧急使用授权(EUA)后,以 ...
|
|
COVID-19 疫苗公众教育与研发同样重要
2020.07.23
【编者按】在全球疫苗研发人员争分夺秒开发 COVID-19 疫苗之时,我们不能忘记另外一个重要的人群:疫苗所服务的普通大众。研发者开发出安全有效的疫苗,制造商接过接力棒生产出高质量的产品,所有这些努力最后还有临门一脚 — 人们愿不愿意伸出手臂让小瓶中的液体注入自己体内。而...
|

|
国际监管机构商定新冠疫苗效力试验的严格标准
2020.07.14
国际药品监管机构联盟(ICMRA)最近的一次会议上商讨勾勒出候选新冠(COVID-19)疫苗进入后期试验之前应满足的标准,以及如何设计 III 期试验,应包括哪些人群等。
7 月 9 日 ICMR 举行网络研讨会上,各国监管机构建议 COVID-19 疫苗的 III 期试验应具有已确立效力的“严...
|
|
FDA 新冠疫苗开发与许可指南,首次提出明确保护效力...
2020.07.02
保护效力至少为50%,不会降低紧急使用授权门槛,替代终点短期内不可行
美国 FDA 于 6 月 30 日发布了《预防 COVID-19 的疫苗研发和许可》立即生效指南,为申办人设定了开发 COVID-19 疫苗的标准:保护效力(efficacy)至少为 50%。该建议旨在确保不会将资源浪费在仅有有...
|
|
FDA 拟制定 COVID-19 疫苗研发和许可指南
2020.06.26
美国 FDA 生物制品审评与研究中心(CBER)于 6 月 24 日发布了 2020 年指南制定计划的修订版本,增加了一些计划发布的指南,其中包括《开发和许可预防 COVID-19 的疫苗》可能会吸引广泛兴趣。但目前尚不清楚该指南将何时发布。
这份指南制定计划在 2 月份发布的初版基础上的修订...
|
|
FDA 根据替代终点加速批准 HPV 疫苗用于预防头颈癌
2020.06.15
批准基于疫苗在预防 HPV 相关肛门生殖器疾病方面的有效性数据,尚无在预防头颈癌方面的试验数据
FDA 于 6 月 12 日批准了美国默克公司的 HPV 疫苗 Gardasil 9 扩大适应症用于预防头颈部癌症(主要是口咽癌)。
该批准决定没有改变之前批准的有关该疫苗的接种建议 — 建议...
|
|
中国和印度竞相准备向全球提供疫苗
2020.06.09
中国政府计划将疫苗作为公共产品全球提供,印度企业巨头将向贫困国家提供10亿剂疫苗。
新型冠状疾病(COVID-19)大流行的全球背景下,凸显了全球卫生竞争与合作的重要性,全球多种疫苗、治疗药同时开发、多管齐下。6 月 7 日国务院新闻办公室举行的《抗击新冠肺炎疫情的中国行动》...
|

|
微针阵列贴片疫苗的优势与生产考虑
2020.05.09
微针阵列贴片(MAP)已被开发作为注射针剂的替代品,用于注射疫苗和其它药物。微针贴剂与透皮贴剂不同,透皮贴剂通过皮肤的最外层(角质层)输送药物,而微针则刺穿角质层并将药物输送到表皮或真皮的上部,但深度不足以引起疼痛。微针技术包括涂有药物的固体微针、填充有液体药物的中空微...
|

|
更快获得新冠疫苗:监管机构应如何做?
2020.04.24
新型冠状病毒疫情(Covid-19)在大部分地区正趋于稳定,许多国家和地区开始讨论逐步恢复到“正常”状态,但是在没有疫苗的情况下是很难恢复到大流行之前的常态的。目前有 70 多个在研疫苗,那么距离疫苗真正可用的那天还有多久呢?曾在 FDA 作为病毒学家任职 15 年并且是 FDA ...
|

|
【质量对话】通向 Covid-19 疫苗之路的系列短片
2020.04.19
编辑: 美国强生公司从本周开始,每周二播放30分钟一集,共八集的系列报道“通向疫苗之路 (The Road to a Vaccine),网址:JNJ.com/roadtoavaccine”,由新闻记者和制片人Lisa Lin播出。这周播出的第一集的标题是“Covid-19疫苗可能的作用是什么?需要多久才能研制出来?”主...
|
|
专家提醒对 COVID-19 疫苗的紧急使用授权应格外谨...
2020.04.07
当前针对新型冠状病毒疫情(COVID-19)疫苗的研发各机构都在紧锣密鼓的进行中,至少三例已经进入了 1 期临床,包括康希诺生物的 Ad5-nCoV,Moderna 公司的 mRNA-1273,以及牛津大学的 ChAdOx1。随着疫情日益严重,人们都希望有效的疫苗能够尽快上市,但三名前 FDA 部门负责人和...
|
|
全球监管机构定义新冠疫苗临床前数据要求并解决疫苗诱...
2020.03.27
随着各制药公司争相开发用于新型冠状病毒疾病(COVID-19)的疫苗,国际药品监管机构联盟(ICMRA)于 3 月 24 日发布了针对 COVID-19 候选疫苗进行首次人体临床试验之前所需的数据的会议报告 pdf,以期在需要足够可靠的数据以做出决策以及支持此类产品的快速开发之间取得平衡。
在 ...
|