
|
FDA 发布组合产品使用者付费定稿指南
2024.07.17
美国 FDA 于 7 月 16 日发布了针对申办人的定稿指南《组合产品申请使用者付费》,解释了其将如何评估组合产品的使用者付费以及申办人可根据处方药使用者付费法案(PDUFA)和医疗器械使用者付费修正案(MDUFA)申请使用者费用豁免的不同计划。
该指南取代了 2005 年 4 月发布...
|

|
FDA 发布组合产品使用相关风险分析指南草案
2024.07.10
美国 FDA 于 7 月 8 日发布了题为“药品、生物制品和组合产品的使用相关风险分析的目的和内容”的指南草案,提供了关于使用相关风险分析(use-related risk analysis,URRA)的指导,以及如何使用 URRA 及其它信息来确定产品开发过程中的人为因素(Human Factor,HF)数据需求...
|

|
FDA 指南草案:简化药物递送器械开发
2024.07.02
美国 FDA 于 6 月 28 日发布了题为“用于递送药品和生物制品的器械的基本药物递送输出”的指南草案,旨在通过提高包含在申请中的药物递送性能信息的一致性,促进和简化用于递送药品和生物制品的独立器械以及包含器械组成部分的组合产品的开发。
指南介绍了 FDA 关于对建立和评...
|

|
FDA 专家会一致投票反对批准长效 GLP-1 糖尿病植...
2023.09.26
美国 FDA 内分泌和代谢药物专家咨询委员会以 19 比 0 的投票结果一致反对 Intarcia 糖尿病植入物 ITCA 650 的批准。专家们基本上同意 FDA 对该治疗产品现有的安全性的担忧,其中包括急性肾损伤、主要不良心血管事件和其它严重不良事件的风险。
Intarcia 的糖尿病植入...
|

|
FDA 定稿药械组合产品应用“人因工程原则”的问答指...
2023.09.08
美国 FDA 于 9 月 7 日发布了“药品器械组合产品人因工程原则应用:问题与解答”指南,进一步明确了人因工程原则在组合产品研发各阶段的考量要点,包括产品设计、临床前研究以及上市前验证,以促进组合产品的开发。
指南重点关注了组合产品的独特方面如何影响人因工程(Human Factors ...
|

|
FDA 组合产品 CGMP 替代和简化机制清单定稿
2022.09.15
美国 FDA 于 9 月 13 日发布了一份定稿 CGMP 替代规定清单,为组合产品提供了 CGMP 简化机制。
FDA 最初于 2018 年 6 月发布了一份组合产品 CGMP 合规的替代或简化机制拟议清单 的要求,法案要求 FDA 将此类清单发布在联邦公报上并定期更新。在之后的公众意见征询...
|

|
FDA 发布药械组合产品检查合规手册
2020.06.06
美国 FDA 于 6 月 4 日发布了新的合规项目指南手册(CPGM)7356.000《检查 CDER 或 CDRH 主管的组合产品》,解释了其对由药品审评与研究中心(CDER)或器械与放射健康中心(CDRH)主管的组合产品制造商的检查方法。
FDA 于 2013 年 1 月颁布组合产品 CGMP 最终规定,2017...
|

|
FDA 发布指南讨论组合产品申办人与 FDA 沟通的最佳...
2020.01.04
美国 FDA 于 12 月 23 日发布《请求 FDA 对组合产品反馈》的指南草案,讨论了组合产品申办人如何从 FDA 获得有关科学和监管问题的反馈,并介绍了当 FDA 与申办人进行互动时的最佳实践。指南指出,这些互动可以通过基于申请的会议机制(通常是最有效的沟通方法),或者通过组合产品...
|

|
吸入器与吸入制剂的当前挑战与开发趋势
2019.12.30
从历史上看,吸入药物递送仅限于呼吸系统疾病的治疗和管理,例如哮喘或慢性阻塞性肺病。然而,这种递送方法已经扩展为许多系统疾病的替代治疗方案,包括内分泌和神经系统疾病,这些疾病可以受益于吸入性递药方案提供的频繁脉冲式给药。
与口服或注射给药相比,吸入性替代方案更好地模拟...
|

|
FDA 希望通过数字健康工作组解决药品软件组合产品相...
2019.11.02
随着软件和药之间的联系日益紧密,美国 FDA 已调集其专家人员成立数字健康工作组,以做出政策决定并帮助申请审评人员。该工作组将解决与药品共同使用的软件有关的政策问题。工作组包括来自器械与放射健康中心(CDRH)和药品审评与研究中心(CDER)以及组合产品办公室的代表。
CDER ...
|

|
FDA 允许某些组合产品软件通过 DMF 提交
2019.10.30
美国 FDA 于 10 月 28 日发布《CDER 主导的使用电子或软件的器械组成部分的组合产品的 V 类 DMF》指南草案,允许将某些电子或软件组成部分作为药物主文件(DMF)提交来进一步简化组合产品批准流程。
当 FDA 药品审评与研究中心(CDER)主导申请评价时,申报人可以使用 V 类...
|
|
组合产品上市后 CDMO 策略
2019.09.04
组合产品公司应如何监控产品、工艺或监管变化带来的影响?
应采用哪些技术文件和支持程序来开展有效的上市后产品管理?
如何管理诸如纠正和预防措施(CAPA)、投诉和变更控制等上市后问题?谁负责评估这些系统,如何对多个供应商进行管理?
本文针对的是那些已有组合产品上市或者正...
|

|
FDA 推迟组合产品安全报告的合规执法日期
2019.04.30
美国 FDA 于 4 月 23 日发布即时生效的指南文件《组合产品上市后安全报告(PMSR)合规政策》,宣布将对 2016 年 12 月 20 日发布的组合产品上市后安全报告最终法规中规定的某些安全报告要求行使执法自由裁量权(Enforcement Discretion),并将这一行动编入法案 21 CFR 第 ...
|

|
FDA 对于复杂仿制药与原研药的标签差异把控或有松缓...
2019.02.20
美国 FDA 于 1 月 30 日批准的重磅哮喘治疗吸入器的仿制产品 — Mylan 公司 Wixela Inhub(丙酸氟替卡松/沙美特罗)的患者使用说明明显不同于参照产品 GSK 公司的 Advair Diskus(舒利迭),反映了 FDA 在复杂仿制药方面愿意接受某些器械设计和标签的差异。【Advair 吸...
|

|
FDA 发布组合产品上市前路径原则指南草案
2019.02.09
美国 FDA 于 2 月 5 日发布《组合产品上市前路径原则》指南草案,提供了 FDA 关于组合产品上市前审评原则的当前考量,包括指导申请人针对自身产品应选择哪种上市前提交类型。指南提供了与组合产品相关的一般性、高层级的信息。
FDA 发布该指南草案是作为实施《21 世纪医药法...
|
|
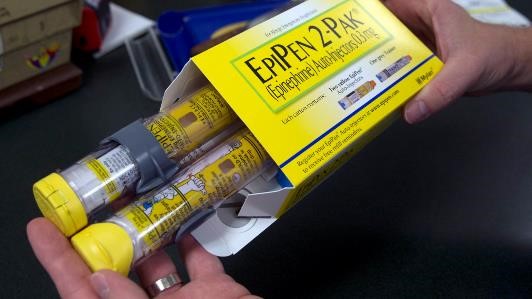
两支售价数百美元的 EpiPen 仅值 24 美元?
2018.11.21
一支 EpiPen 真正价值几何?根据一项基于成本效益基准的分析1 表明,一盒两支装用于抗过敏的肾上腺素自动注射器 EpiPen 的价值仅为每年 24 美元。
这篇发表在 JAMA Network Open 上的研究使用模拟模型,通过假设 EpiPen 与类似药械组合产品可以使花生过敏的死亡风险降低 1...
|
|
FDA-DIA 复杂药械组合产品研讨会简报
2018.10.15
https//www.fda.gov/Drugs/NewsEvents/ucm617128.htm FDA/DIA 复杂药械组合产品研讨会于 10 月 9 -10 日在美国 Silver Spring 召开。会议第一天涉及这类产品仿制药提交的监管内容,并讨论了与复杂仿制药相关的临床内容,重点是吸入产品。
FDA 演讲者重点关注的话...
|
|
FDA 将试点主动更新旧仿制药标签
2018.01.30
美国 FDA 有兴趣建立一个更容易推动仿制药标签更新的系统,而不是等待仿制药申办人独立行事。
FDA 局长 Scott Gottlieb 于 1 月 26 日在瑞士达沃斯世界经济论坛的一个小组会议上表示,FDA 正在寻求“对旧仿制药标签开展主动更新。”这一概念听起来可能类似于现在已撤销的仿...
|

|
FDA 对于复杂仿制药的监管可能会有更大灵活性
2017.11.29
美国 FDA 局长 Scott Gottlieb 关于药械组合仿制产品的讲话可能预示着,仿制药办公室(OGD)在一定程度上在允许仿制产品和创新产品之间的标签差异方面具有更大灵活性。
Gottlieb 在 11 月 28 日针对 FDA 科学家和研究人员的 FDA 内部活动“仿制药科学日”的讲话中,强调了 ...
|

|
FDA 药品器械及组合产品分类指南的不足
2017.10.24
美国 FDA 于 9 月 26 日发布的关于《药品和医疗器械的分类以及其它产品分类问题》的定稿指南为行业提供了一些有用的澄清,但专家仍然担心,指南包含了太多空间让 FDA 继续将产品分类在更严格监管的药品路径下的趋势。
Epstein Becker & Green 律所的 James Boiani 律师...
|