
|
WHO 亚硝胺污染的预防与控制 GMP 考量指南草案
2024.04.19
世界卫生组织(WHO)于 4 月 12 日发布《预防和控制药品中亚硝胺污染的 GMP 考量》指南草案,以帮助辅料、原料药和成品制剂生产商采取行动降低其产品中的亚硝胺杂质风险。
WHO 指出,为控制药品中亚硝胺的存在,生产商应熟悉其产品中亚硝胺杂质的根本原因,制定并实施全面的风险...
|

|
WHO 药用辅料GMP附件1:生产和控制风险管理
2024.04.18
世界卫生组织(WHO)于 4 月 12 日发布《WHO 药用辅料 GMP — 附件 1 :药用辅料生产和控制的风险管理》指南草案,为药用辅料生产商、包装商和分销商提供指导,以确定可能对辅料的生产、控制、质量和纯度产生负面影响的风险和危害。
WHO 正在就该附件草案向公众征求意见,截止...
|

|
WHO 药用辅料GMP附件2:高风险辅料示例清单
2024.04.18
世界卫生组织(WHO)于 4 月 12 日发布《WHO 药用辅料 GMP — 附件 2:高风险辅料示例清单》,提供了高风险辅料和污染物的示例清单,以提醒此类辅料的生产商以及含有此类辅料的成品制剂生产商采取措施以确保此类辅料和成品制剂的安全性、纯度和质量。
WHO 表示该清单将不定期...
|

|
【周末杂谈】FDA不搞GMP企业认证,原来是妥协之举
2024.03.24
由此产生了对生物产品上市申请BLA中“L”的新理解
FDA的GMP监管,是针对产品而不是企业的。不存在企业GMP合规,只能说企业某产品的生产是GMP合规。FDA批准产品上市是对其安全、有效和质量的认可。对质量的认可,包括认为企业在实际生产中靠GMP合规来满足产品申报中有关成分、工艺、检...
|

|
印度卫生部发布最终版 GMP 修订规定
2024.02.08
印度联邦卫生部于 2023 年 12 月 28 日发布最终版 GMP 修订规定 —— 附录 M,该规定涉及药品生产质量管理规范以及场所、厂房和设备的要求,其中包括年度产品质量回顾(PQR)、质量风险管理(QRM)、药品质量体系(PQM)等,以使印度的制药和生物制药标准与国际标准保持一致。...
|

|
FDA 发布医疗器械质量管理体系法规(QMSR)最终规章
2024.02.06
美国 FDA 于 1 月 31 日发布了质量管理体系法规(QMSR)最终规章,修订了质量体系(QS)法规中医疗器械现行生产质量管理规范(CGMP)要求,以与国际共识标准 ISO 134852016 保持一致。
FDA 表示,该最终规章将确保不同监管制度下对器械生产商的监管期望保持一致,同时每年为行...
|

|
欧盟更新 GMP 无菌附录问答
2024.02.02
2024年1月,欧盟更新了《GMP和GDP问答》的无菌附录部分,新增了3个问答,更新了1个,删除了5个,有2个问答保持不变。
本次更新主要内容包括:
1. 2022版附录1发布后,内容已经涵盖部分原有问答,对这些问答进行了删除;
2. 部分问答参考的指南内容有变化,更新了这部分问答;
...
|
|
FDA 更新 GMP 问题降级以缩短增补批准时间的指南手...
2023.12.27
美国 FDA 于 12 月 21 日修订政策和程序手册(MAPP)5021.5 Rev.1 基于设施的缺陷从主要到次要增补重新分类请求的评价,用于重新评价原始简化新药申请(ANDA)和相关需事先获批补充申请(PAS)的基于设施的主要完全回应函(CRL)增补。
根据 2022 年仿制药使用者付费修正案(GDU...
|

|
欧美监管机构发布突破性治疗申请的 CMC 和 GMP 联...
2023.12.22
欧洲药品管理局(EMA)和美国 FDA 于 12 月 19 日发布了“EMA-FDA 关于 PRIME/突破性疗法应用的质量和 GMP 方面的联合问答”文件,以支持 EMA 优先药物(PRIME)计划和 FDA 的突破性治疗(BT)认定计划中产品的质量开发。
PRIME/BT 两个计划旨在帮助加快创新产品的开...
|

|
FDA 检查发现莫德纳生产工厂存在质量控制缺陷
2023.12.20
美国 FDA 于 9 月 11 日至 21 日对麻萨诸塞州 Norwood 的莫德纳(Moderna)工厂进行了检查,发现莫德纳的主工厂存在质量控制缺陷,包括用于生产新冠疫苗原液的设备也存在控制缺陷。
该工厂用于生产莫德纳的新冠疫苗 Spikevax 以及与默沙东公司共同开发的实验室性 mRNA 癌症疫苗...
|

|
细胞治疗产品常见的 CMC 和 GMP 检查缺陷分析
2023.12.13
最近细胞治疗产品企业的 CMC 和 GMP 问题可能给药企带来了深刻的教训。识林分享一篇今年 9 月份给企业会员发送的分析文章,希望大家能够吸取经验教训,早做准备。
另外,还可参考识林去年发布的 FDA 对细胞和基因治疗产品的检查和常见缺陷统计以及最近 FDA 因 CGMP 问题向诺华 C...
|
|
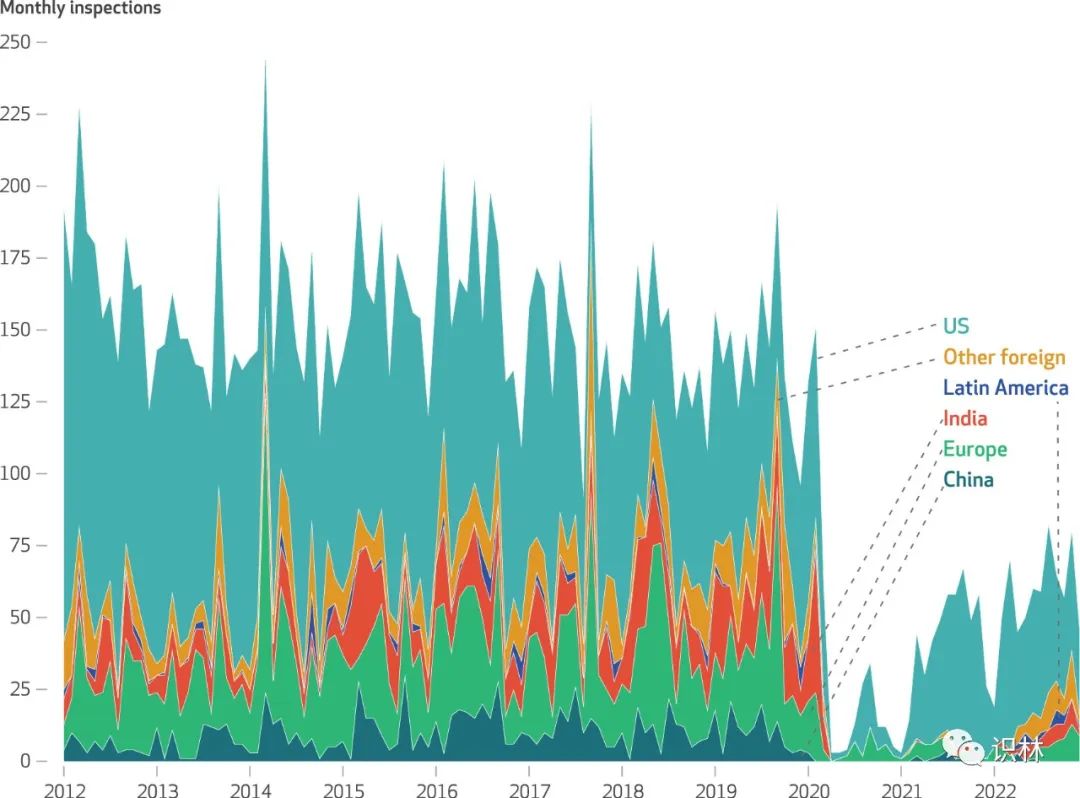
分析报告显示 FDA 对海外药品生产监管力度仍远低于...
2023.12.06
根据 12 月 4 日发表在《卫生事务》(Health Affairs)上的一篇题为“FDA 全球药品检查:对生产企业的监督仍远低于新冠(COVID-19)之前的水平”(FDA Global Drug Inspections Surveillance Of Manufacturing Establishments Remains Well Below Pre-COVID-19 Level...
|

|
【转载】一场惊心动魄的探险之旅 — 学习欧盟无菌药...
2023.11.03
以下文章来源于https//mp.weixin.qq.com/s/qF9ElhGl5sThgiLx81eWfA 老吴讲讲GMP ,作者吴军
想最快捷、最全面、最专业的学习、掌握、去实践相关的药品生产与质量管理知识、经验与能力,就是通过学习欧美国家颁布的相关法规与技术指南文件、或者阅读相关专业书籍、或者在外资企...
|

|
合规专家点评FDA警告信后会议指南草案
2023.09.21
美国 FDA 于 9 月 5 日发布了题为“GDUFA 下的警告信后会议”的指南草案,概述了某些仿制药生产场地可以要求与 FDA 召开警告信后会议(Post-Warning Letter Meeting)的程序,在会议上药企可以与 FDA 讨论正在进行的补救和纠正措施,以解决警告信中提到的 CGMP 缺陷。
...
|

|
欧盟 GMP 问答新增外包活动相关问答:多方分包合同...
2023.08.01
欧盟 GMP 问答近日新增了在外包活动方面的一个问答,涉及对于认证前批次多方分包的合同要求。
上市许可持有人(MAH)和负责质量受权人(QP)认证的进口许可(MIA)持有人是否需要与参与认证前的批次生产、进口、检测和贮存各个阶段的场地之间直接签署协议?
欧盟 GMP 第 7 章...
|

|
监管机构官员谈全球合规问题及如何实现可持续 GMP ...
2023.06.14
美国和欧洲的监管机构官员在上个月的 ISPE 欧洲年会小组讨论上表示,供应链监督不力、检测不安全成分的药典方法不足、设施老化和质量管理不善是它们在全球合规方面最为关心的问题。
会上,监管机构官员被问及他们最关心的全球问题,讨论制药商如何实现可持续的 GMP 合规,以及如何...
|

|
药品GMP指南(第2版)无菌制剂分册细胞治疗产品部分:...
2023.06.06
历经18个月,来自超过130家单位的500余位监管和产业专家完成了4500余页,近500万字的药品GMP指南(第2版)。受指南起草牵头单位--北京大学知识工程与监管科学实验室委托,我们对指南无菌制剂分册编写小组的专家开展了系列访谈,将从无菌制剂、生物制品(单抗)、细胞治疗产品三部分,...
|

|
GMP指南研讨课测评详解 -- 专业能力体系化评估案...
2023.05.26
编者荐语:
缺乏客观反馈,学习效果难有实质提升。IPEM的测评和分析,正是“学习-反馈-精进”的正向循环的体现,这也同样是识林【能力提升】年度岗位定制培训所秉承的理念。需要系统性培训和测评的企业,可联系识林,了解更多。
以下文章来源于IPEM ,作者IPEM
5月18-21...
|

|
药品GMP指南(第2版)原料药分册的变化:分册编委专访
2023.05.19
历经18个月,来自超过130家单位的500余位监管和产业专家完成了4500余页,近500万字的药品GMP指南(第2版)。受指南起草牵头单位--北京大学知识工程与监管科学实验室委托,我们对指南编写小组的专家开展了系列访谈,第七篇请到原料药分册组长王卫兵及编委代表介绍该分册的主要变化。
...
|

|
识林沙龙 GMP指南(第2版)研讨课后沙龙
2023.05.16
5月18日、5月20日1900-2100,识林将邀请IPEM课程老师,分别就《药品GMP指南(第2版)》质量体系分册和无菌制剂分册编写过程中重点和难点话题,开展课后沙龙,欢迎上海周边的识林会员报名参加,共20个名额,请扫码报名。经识林确认报名成功后,方可参加。
注意:沙龙为仅对上课学员...
|