
|
欧盟发布新冠疫苗批准考量,欧美将相继于下月直播疫苗...
2020.11.23
欧洲药品管理局(EMA)于 11 月 19 日发布对新冠(COVID-19)疫苗批准的思考,讨论了 EMA 对上市许可(MA)申请中临床、有效性、安全性以及上市后随访的要求。欧洲 EMA 和美国 FDA 将于北京时间 12 月 11 日前后分别召开 COVID-19 疫苗公开会议。
EMA 关于新冠疫苗批准...
|
|
瑞德西韦:WHO不建议用于新冠治疗,FDA授权与抗炎药联...
2020.11.21
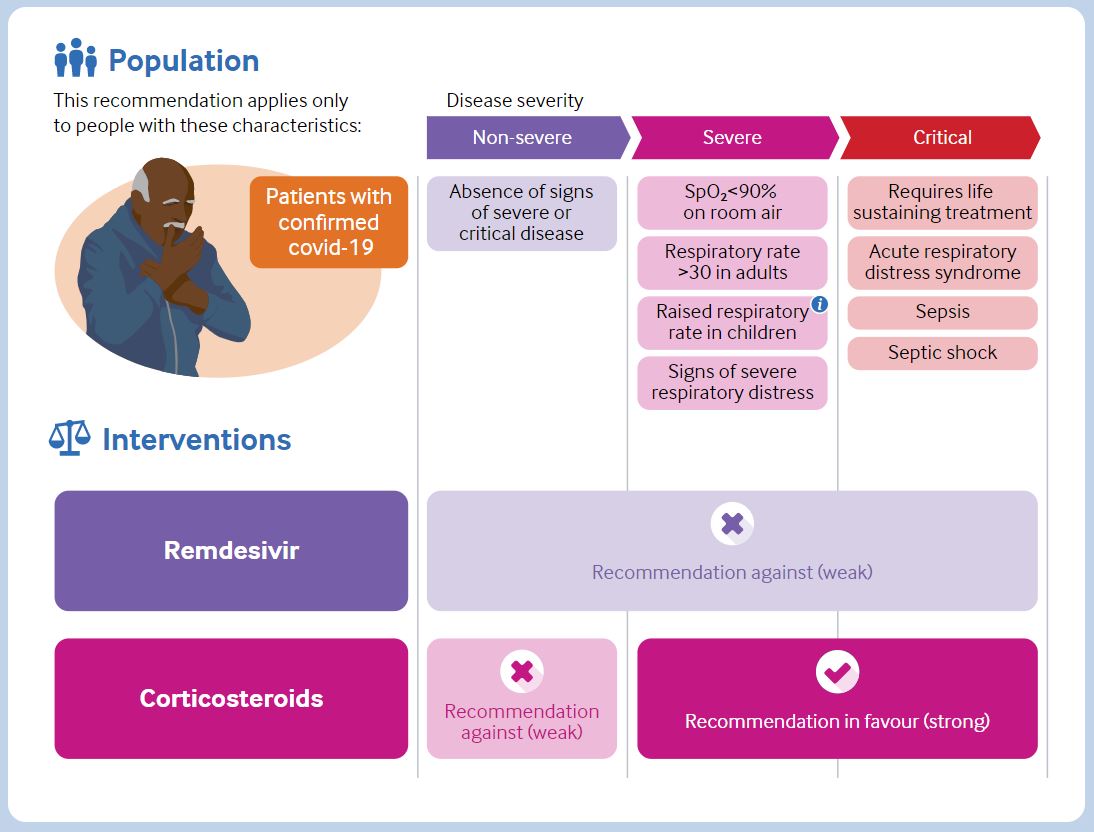
世界卫生组织(WHO)于 11 月 19 日发布的一份修订指南中建议:不要使用抗病毒药瑞德西韦(Veklury,吉利德公司)治疗新冠(COVID-19)。
根据 WHO 指南制定小组表示,“无论其病情严重与否,不建议对 COVID-19 住院患者使用抗病毒瑞德西韦,因为目前尚无证据表明抗病毒药物...
|

|
辉瑞新冠疫苗完成有效性分析,不日将提交紧急使用申请
2020.11.19
辉瑞和 BioNTech 于本周三宣布,其新冠(COVID-19)候选疫苗试验有效性分析已经完成,数据表明该疫苗具有 95% 的保护效力。两家公司表示计划在“几天之内”向美国 FDA 提交紧急使用授权(EUA)申请,并将向全球监管机构提交申请。
上周一辉瑞和 BioNTech 宣布研究的早期分析...
|

|
透明带来信任:FDA 宣布披露用于支持紧急使用授权的...
2020.11.18
美国 FDA 于 11 月 17 日发布通告承诺公开披露用于授权、修订或撤销药品紧急使用授权(EUA)的科学数据和其它审评信息。
FDA 局长 Stephen Hahn 在一份声明中表示,“我们认识到,披露科学审评文件中支持针对包括疫苗在内的药品和生物制品的 EUA 的发布、修订或撤销的信息,...
|

|
Moderna 宣布新冠疫苗保护效力达百分之九十四,或可...
2020.11.17
Moderna 公司于美国时间本周一早上宣布,其疫苗在预防新冠(COVID-19)方面的保护效力为 94.5%,与辉瑞/BioNTech 上周对自己的疫苗宣布的结果相当或略胜一筹。辉瑞公司上周表示,他们的疫苗保护效力“超过 90%”。【辉瑞新冠疫苗III期期中分析显示 90% 保护力,后续可期待些什么?】...
|

|
【周末杂谈】精英与百姓
2020.11.15
读美国媒体对辉瑞新冠疫苗报道的一些潜台词
这周一,美国辉瑞宣布其正在做III期临床的新冠疫苗有效性高达90%。【辉瑞新冠疫苗III期期中分析显示90%保护力,后续可期待些什么?】新闻一出,华尔街飞涨,政客邀功,媒体报道不断。与此同时,出于种种原因,百姓对疫苗的态度,日趋消极。9...
|

|
美参议员要求 FDA 提供疫情期间国外药品检查状况与...
2020.11.13
2020 年 3 月,由于新冠疫情,FDA 推迟了对国内外药物生产场地的所有检查,至今仍没有恢复对国外场地的检查。【FDA 宣布恢复国内检查,那么国外检查呢? 2020/07/16】美国参议员们表达了担忧。11 月 10 日,参议院卫生、教育、劳工和退休金(HELP)委员会的两名民主党议员 Elizabeth ...
|

|
礼来新冠治疗性抗体获紧急授权,GMP 合规要求为授权...
2020.11.12
美国 FDA 于 11 月 9 日发布了针对礼来 COVID-19 治疗性单克隆抗体 bamlanivimab 的紧急使用授权(EUA)。该 EUA 独特之处是将 GMP 合规要求列为授权条件之一。授权书解答了 FDA 是如何解决对礼来新冠治疗性抗体的迫切需要与在生产设施检查中发现严重 GMP 问题之间的冲突。
Ba...
|

|
FDA 相关负责人在仿制药会上小结 2020 年工作
2020.11.11
一年一度的美国普享药协会(AAM,原仿制药协会)GRx+Biosims 于 11 月 9 日召开,今年的会议由于疫情原因通过网络在线召开。
AAM 新任总裁兼首席执行官 Dan Leonard 在会议开始时介绍了 AAM 的现状以及他们和 FDA 所做工作的重要性。FDA 局长 Stephen Hahn 概述了与大流...
|

|
辉瑞新冠疫苗III期期中分析显示百分之九十保护力,后...
2020.11.10
94 例感染病例,数据和关键信息尚不可得,本月下旬或提交 EUA。
美国辉瑞和德国 BioNTech 于美国时间本周一早晨表示,他们的新冠(COVID-19)候选疫苗非常有效,超出预期。该疫苗是首个在美国进行大规模 III 期试验产生后期数据的疫苗。两家公司表示,对结果的早期分析显示,相...
|
|
欧洲药品管理局将不会为新冠候选疫苗设定最低保护效力...
2020.11.06
根据路透社消息,欧洲药品管理局(EMA)于昨日表示,在考虑批准潜在的 COVID-19 疫苗时,不会设定最低保护效力标准,这与美国 FDA 目前采取的做法不同。
EMA 在一封电子邮件中表示,人体研究需要证明令人信服的保护效力水平,但是一个疫苗是否被认为是可接受的将根据所有关于安全...
|

|
FDA 紧急使用授权程序正逐步改善,应更加透明
2020.11.04
美国 FDA 从早期 COVID-19 紧急使用授权(EUA)中吸取的经验教训可能会大大提高公众对未来治疗药 EUA 或疫苗 EUA 以及监管程序本身的信任。美国达特茅斯学院政府学系研究药物监管政策的 Herschel Nachlis 在卫生事务博客上发文1,总结了从 FDA 康复期血浆 EUA、COVID-19 ...
|

|
FDA 新冠疫苗首次咨询委员会会议辩论了哪些内容?
2020.10.24
美国 FDA 于昨日就 COVID-19 疫苗召开了第一次咨询委员会会议,这可能是 FDA 113 年历史上最令人期待的一次会议了。会议广受关注,FDA 通过 Youtube 向公众直播了会议的全过程,在将近 9 个小时的时间里,有 18 位不同的外部专家听取了公共卫生机构和基金会以及企业的介绍...
|
|
FDA 正式批准瑞德西韦用于新冠治疗
2020.10.23
美国 FDA 今日正式批准了吉利德公司(Gilead)的抗病毒药 Veklury(瑞德西韦)用于 12 岁及以上、体重至少 40 公斤的需要住院的 COVID-19 成年和儿科患者,成为首个获得 FDA 正式批准的 COVID-19 治疗药物。
该批准不包括最初于 2020 年 5 月 1 日签发的紧急使用授权(EU...
|
|
新冠疫苗开发者希望 FDA 提供安慰剂对照的替代方法
2020.10.22
美国 FDA 在本月初发布的新冠疫苗紧急使用授权(EUA)指南中提出明确期望,在新冠 EUA 发布,申办人应可行的范围内继续收集安慰剂对照数据以提交正式生物制品许可申请(BLA)。但是疫苗企业表示,这一提议可能是不道德或不现实的。而疾病组织也表示这一提议可能会潜在地提高 EUA 的...
|

|
欧盟新冠疫苗部署计划:接种优先级,安全性研究和信任...
2020.10.21
欧盟委员会正在研究在欧盟成员国之间公平分配未来新冠(COVID-19)疫苗的方法,并表示正在制定计划,加强对投放市场的任何疫苗的安全性监督。委员会还敦促政府当局“独立于企业进行疫苗有效性和安全性研究,确保尽快收集和评估任何新的上市后信息,并采取措施应对疫苗错误信息。”
正...
|
|
FDA 疫苗负责人强调新冠疫苗紧急使用授权后安慰剂对...
2020.10.19
美国 FDA 官员表示,即使在紧急使用授权(EUA)之后,新冠病毒疫苗的试验仍需维持安慰剂对照,以许可多款候选疫苗。
10 月 16 日发表在《新英格兰医学杂志》上的一篇观点文章1中,FDA 生物制品审评与研究中心(CBER)疫苗研究与审评办公室的副主任 Philip Krause和主任 Marion Gr...
|
|
绝大多数航空货运公司未准备好运输新冠疫苗
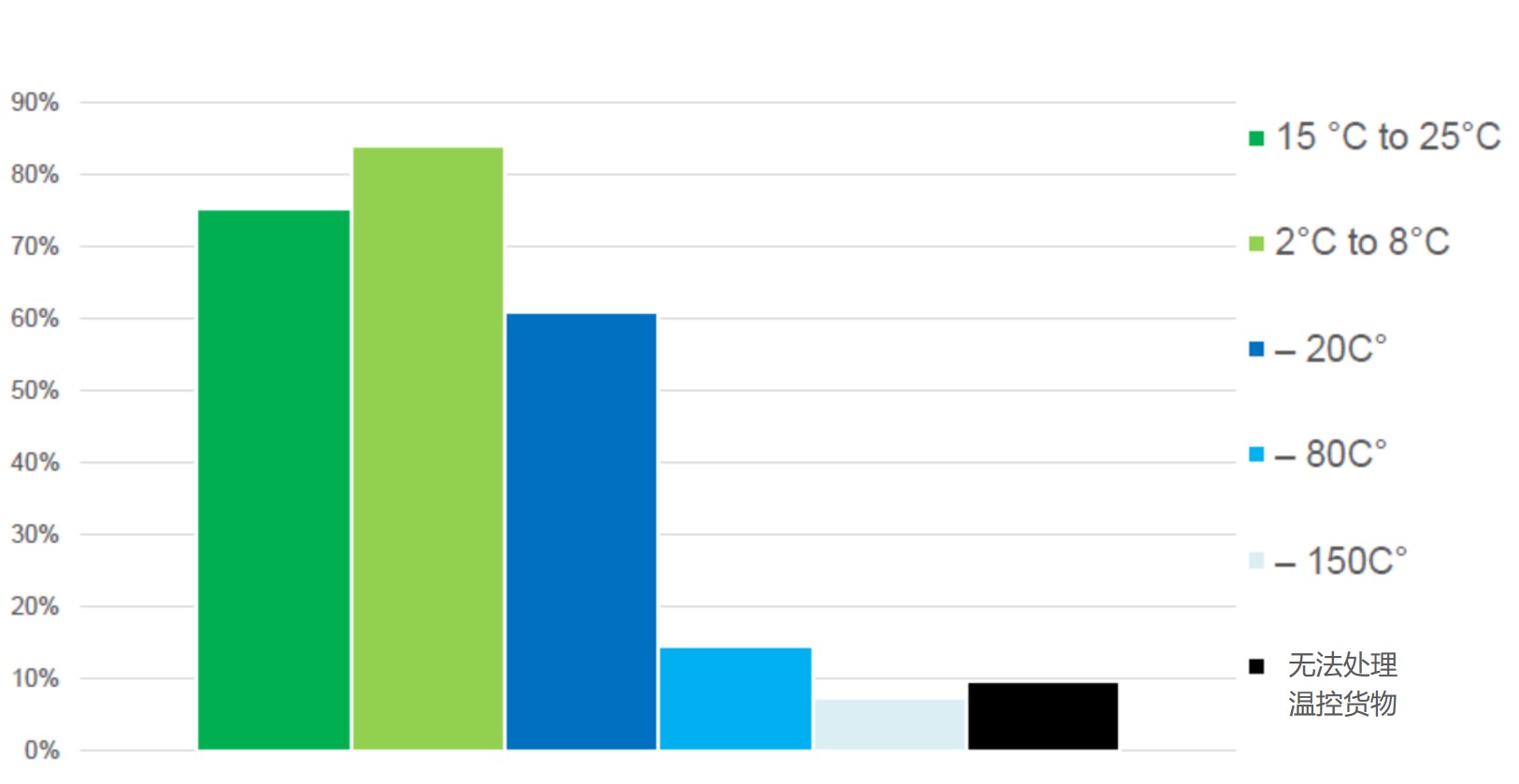
2020.10.16
全球大部分地区的制药公司都在奋力研发新冠疫苗和治疗药以缓解疫情,但一项新的调查显示,目前只有 28% 的航空货运公司做好了在全球范围内运输新冠疫苗的准备工作。同时有 12% 的公司表示他们认为“准备非常不足”,只有 54% 的航空货运提供商拥有一些处理疫苗的必要设备。
这...
|

|
礼来计划生产新冠治疗性抗体的工厂爆出删除数据和造假...
2020.10.15
美国 FDA 检查员在礼来公司的制药工厂发现了严重的质量控制问题,该工厂正在准备生产一种颇具希望的新冠抗体治疗药物。
礼来的实验性药物称为 LY-CoV555,是一种单克隆抗体,与特朗普患病期间使用的 Regeneron(再生元)的药物类似,其作用是识别并锁定外来入侵者,从而阻止健康细...
|
|
FDA 发布新冠疫苗紧急使用授权指南,提出详细信息和...
2020.10.08
美国 FDA 于 10 月 6 日发布了《预防 COVID-19 疫苗的紧急使用授权》指南,解释了紧急使用授权(EUA)的法定标准,并提供了有关 FDA 希望支持 EUA 申请的法规,化学、生产和控制(CMC)以及安全性和有效性信息的建议。
这份 EUA 指南的发布可谓是历尽波折,上个月 FDA 局长 St...
|