
|
国际监管机构就 COVID-19 治疗药临床试验终点达成...
2020.08.04
随着更多有关 COVID-19 潜在治疗药物的临床试验正在进行中,国际监管机构已就主要临床终点达成一致,终点的可接受性主要取决于所涉及的试验人群是中度至重度感染的住院患者还是轻度感染的门诊患者。
国际药品监管机构联盟(ICMRA)在 7 月 31 日发布的一份最新报告中解释了用于治疗 C...
|

|
法律专家回答国内企业关注的 FDA 疫情期间检查的问...
2020.07.30
美国参议院最近召开了题为“COVID-19及后续:对FDA海外制药检查程序的监督”的听证会,要求FDA对海外企业的监管更加严格。在这样的大环境下是否坚持国际化路线,应该如何坚持并应对新局势?
识林联合IPEM教育项目和美国霍金路伟(Hogan Lovells)律所,于7月25日举办了link=13px 线上...
|
|
Moderna 疫苗III期入组标准惹争议,FDA 将开展实时...
2020.07.29
美国 Moderna 公司于 7 月 27 日宣布启动针对其 COVID-19 候选疫苗的关键性 III 期试验,入组标准将排除已知新冠感染史者,引发专家疑问。当天 FDA 局长 Stephen Hahn 表示,FDA 将对 Moderna 公司的候选疫苗执行实时评价机制,实时审评从开始 III 期试验的当天开始...
|
|
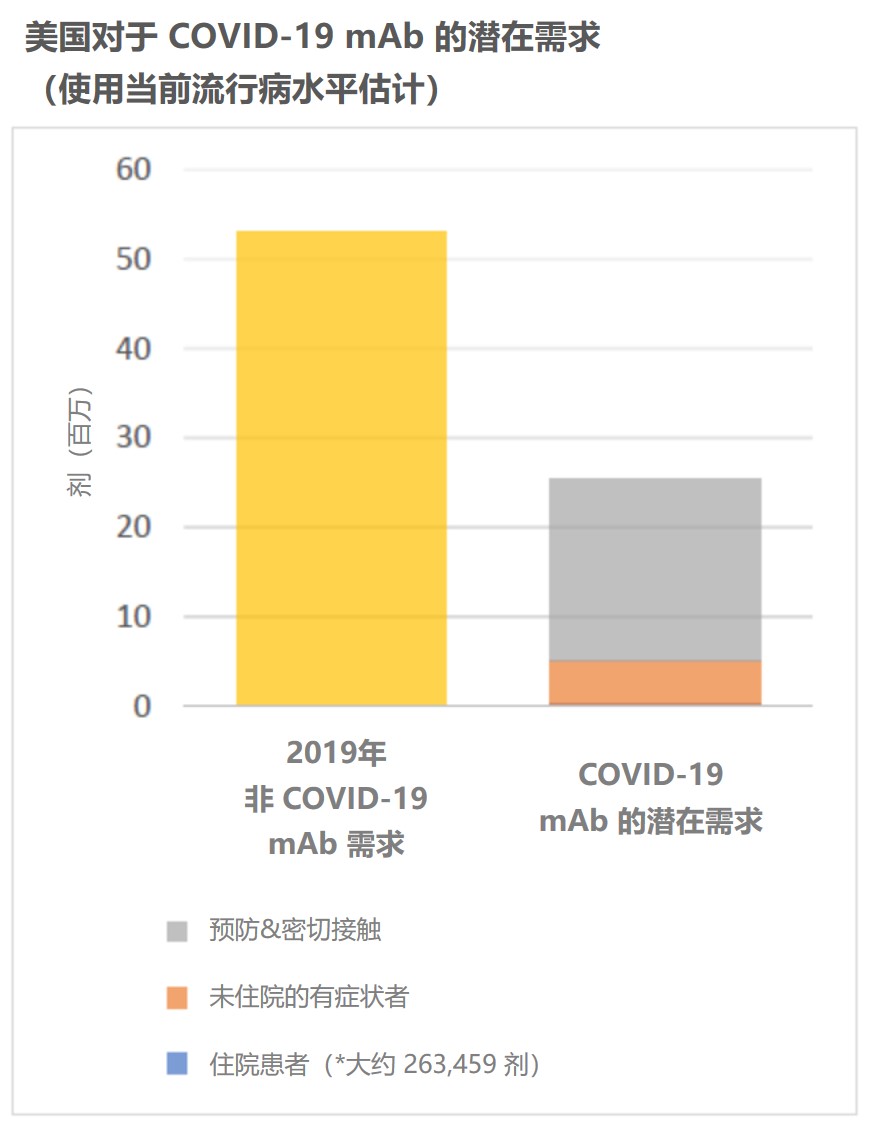
生物制药公司为共享新冠单克隆抗体制造信息扫清监管障...
2020.07.28
美国司法部同意几家大型生物制药公司的申请,对于共享与治疗 COVID-19 的单克隆抗体(mAb)药物相关的某些详细制造信息,不实施任何反托拉斯限制。
正在开发中的用于治疗 COVID-19 的单克隆抗体包括可以直接靶向冠状病毒的中和抗体,以及可以解决急性呼吸窘迫综合症的抗体。中和...
|

|
美国政府与辉瑞达成疫苗最大订单,为新冠疫苗价格定下...
2020.07.24
7 月 22 日,美国政府与辉瑞公司和 BioNTech 美国公司签订了 19.5 亿美元的疫苗购买合同,这是迄今为止美国政府宣布的最高疫苗合同金额。
根据宣布的协议,美国卫生部(HHS)的生物医学高级研究与发展局(BARDA)和国防部将在辉瑞成功制造并获得批准或紧急使用授权(EUA)后,以 ...
|

|
COVID-19 和中美新形势下,中国药企在美风险和应对
2020.07.24
7月23日,FDA举办了题为“面向全球利益攸关方的药品质量(Pharmaceutical Quality for Global Stakeholders)”的大型网络研讨会,会议有超过1700人报名(据说大半来自印度药企,而非中国),尽管这个报名人数远逊于一门普普通通的国内网课(平均3000人,参考识林资讯【网课时代大数据...
|
|
COVID-19 疫苗公众教育与研发同样重要
2020.07.23
【编者按】在全球疫苗研发人员争分夺秒开发 COVID-19 疫苗之时,我们不能忘记另外一个重要的人群:疫苗所服务的普通大众。研发者开发出安全有效的疫苗,制造商接过接力棒生产出高质量的产品,所有这些努力最后还有临门一脚 — 人们愿不愿意伸出手臂让小瓶中的液体注入自己体内。而...
|

|
英国 MHRA 远程药品 GMP 检查经验
2020.07.18
现场/远程混合检查或成新常态,远程检查不是万能药
英国药品与医疗保健产品监管机构(MHRA)正在借鉴以往病毒爆发的经验,推出了一项宏大的远程/现场混合检查计划,以帮助维持现有药品的供应并在 COVID-19 大流行旅行限制下批准新药,并且预计会在大流行结束以后成为新常态。
MHRA...
|

|
线上讲座:FDA对美国本土外制药的监管未来
2020.07.16
COVID-19疫情加速了全球供应链新格局的转变。美国参议院最近召开了题为“COVID-19及后续:对FDA海外制药检查程序的监督”的听证会。听证会上有来自FDA高层(包括监管事务副局长,CDER监管项目副主任,以及全球政策和战略副局长)、政府问责署(GAO)以及行业高管的证词,目的是讨论FDA对...
|

|
FDA 宣布恢复国内检查,那么国外检查呢?
2020.07.16
7 月 10 日,美国 FDA 宣布了其准备从 7 月 20 日的那一周开始重启国内现场检查的目标。接受检查的美国区域应是在 FDA 的评级系统中显示 COVID-19 情况最为安全可以执行优先检查的区域。FDA 的评级系统基于州和国家数据评估了当地的 COVID-19 病例数。
评价级别基于...
|

|
与疫苗同样重要的小瓶:全球医用玻瓶制造火热加速
2020.07.15
随着科学家们竞相在新冠(COVID-19)疫苗开发道路上冲刺,为全球人口接种所需的数十亿医学级玻璃瓶和注射器生产的百团大战也在同时激烈上演。
与生产能够安全有效保护人们免受病毒侵害的疫苗所需的大量科学技术研发和临床试验相比,生产小瓶和注射器的工作看似平平无奇,但同等重要。...
|

|
WHO 对新冠疫情国际应对情况展开独立审查
2020.07.14
WHO 总干事谭德塞于 7 月 9 日在对 WHO 194 个成员方代表的网络会议上宣布对新冠(COVID-19)大流行的国际应对开展独立审查。
独立审查小组(称为大流行病防范和应对独立小组)将由前利比里亚总统、诺贝尔和平奖得主 Ellen Johnson Sirleaf 和新西兰前总理 Helen Clark...
|

|
国际监管机构商定新冠疫苗效力试验的严格标准
2020.07.14
国际药品监管机构联盟(ICMRA)最近的一次会议上商讨勾勒出候选新冠(COVID-19)疫苗进入后期试验之前应满足的标准,以及如何设计 III 期试验,应包括哪些人群等。
7 月 9 日 ICMR 举行网络研讨会上,各国监管机构建议 COVID-19 疫苗的 III 期试验应具有已确立效力的“严...
|

|
瑞德西韦:吸入剂试验启动,仿制药最低53美元一瓶,增...
2020.07.10
吸入溶液早期试验启动
吉利德(Gilead)于 7 月 8 日表示,已经开始对瑞德西韦(remdesivir)用于治疗新冠(COVID-19)的吸入溶液剂型进行早期测试。
吉利德表示,这一安慰剂对照试验将在美国招募约 60 名年龄在 18 到 45 岁的健康受试者,为进一步研究奠定基础,尤其是...
|
|
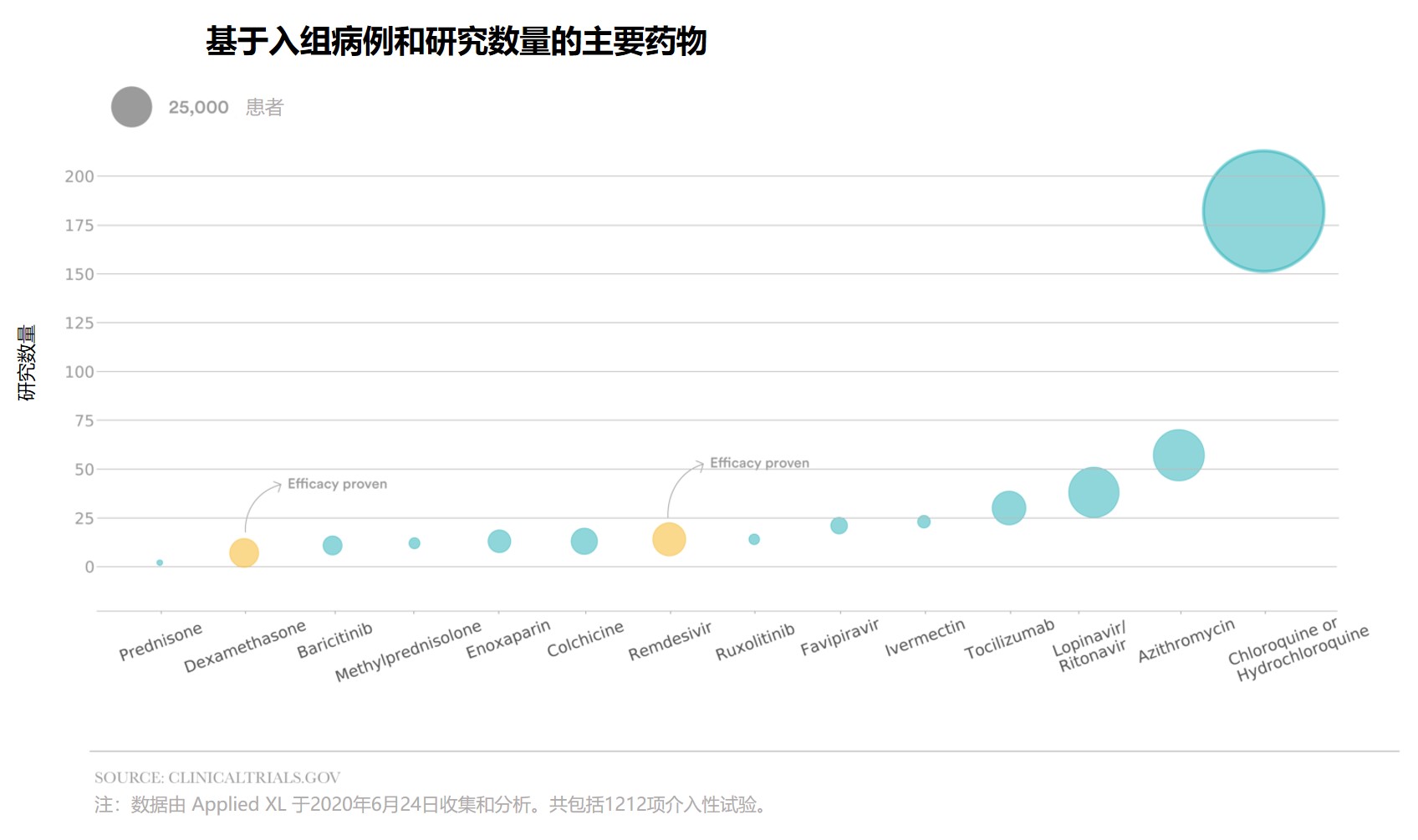
新冠药物临床研究:各自为战,缺乏统筹
2020.07.09
自今年新冠(COVID-19)爆发以来,研究人员针对 COVID-19 的治疗和预防措施设计了大批临床试验,雄心勃勃但混乱不堪,浪费了大量的财力和时间。
STAT 与 Newlab 公司下的 Applied XL 合作进行的一项分析发现,每六项临床试验中就有一项旨在研究抗疟疾药物羟氯喹或氯喹,而最...
|
|
欧盟讨论疫情下药品供应的经验教训:协作,数据,生产...
2020.07.08
7 月 2 日药物信息协会(DIA)2020 欧洲会议上,与会者探讨了欧盟在大流行的头几个月中药品供应链方面的经验教训以及可能采取的确保将来可以更有效地解决供应问题和短缺的步骤。会上得出的一些结论和建议如下:
欧洲国家在冠状病毒大流行期间解决药品供应问题的方式分散,暴露了供...
|

|
因为疫情警告信不能关闭怎么办?
2020.07.03
那些先前在美国 FDA 的检查中发现了严重质量问题的制药商,即使已经做了相应的整改纠正措施,可能也不得不等到新冠(COVID-19)疫情消退之后,FDA 重启后续场地检查,才可能会恢复与场地相关的申请的审评工作。
自 3 月中旬 FDA 宣布除最紧迫的“关键任务”检查外,推迟所有现场检...
|
|
FDA 新冠疫苗开发与许可指南,首次提出明确保护效力...
2020.07.02
保护效力至少为50%,不会降低紧急使用授权门槛,替代终点短期内不可行
美国 FDA 于 6 月 30 日发布了《预防 COVID-19 的疫苗研发和许可》立即生效指南,为申办人设定了开发 COVID-19 疫苗的标准:保护效力(efficacy)至少为 50%。该建议旨在确保不会将资源浪费在仅有有...
|
|
吉利德公布瑞德西韦在美国及部分发达国家的定价
2020.06.30
政府保险每五天疗程价格 2340 美元,商业保险每五天疗程 3120 美元
吉利德(Gilead)公司透露了其备受热议的新冠(COVID-19)治疗候选药瑞德西韦(remdesivir)的价格,可能在某些程度上反映了来自廉价类固醇药物的竞争。
吉利德公司首席执行官 Daniel O'Day 本周一早上在一封https...
|
|
FDA 将发布分散式试验指南,或反映疫情中的经验教训
2020.06.30
FDA 即将发布分散式试验指南,或反映疫情中学到的经验教训
美国 FDA 即将发布的关于分散式试验的指南可能会反映在新冠(COVID-19)大流行期间从使用技术远程收集临床数据中获得的一些经验教训。
FDA 药品审评与研究中心(CDER)临床研究方法学、监管合规和医疗政策制定方面的官员 Isa...
|