|
FDA 发布生物类似药比对分析及其它质量考虑指南草案
2019.05.23
美国 FDA 于 5 月 21 日发布《治疗性蛋白质生物类似药的开发:比对分析评价和其它质量考量》指南草案。指南介绍了 FDA 对于支持生物类似性证明的比对分析研究的设计和评价的建议,包括开发使用逐步方法的比对分析评价计划的考量。指南还向申办人提供了有关拟议生物类似药产品上市...
|

|
FDA 实时肿瘤学审评试点一览
2019.05.22
5 月 15 日,美国 FDA 批准 Venclexta(venetoclax 片剂)用于患有慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的成年患者。FDA 对该申请使用了实时肿瘤学审评(Real-Time Oncology Review,RTOR)和评估协助(Assessment Aid)试点项目,并授予了优先审评以及孤儿药...
|

|
FDA 2019 首仿批准清单更新
2019.05.21
美国 FDA 于 5 月 17 日更新了其首仿药批准清单,这是其今年第二次更新,本年度第一次更新在 3 月 8日 【FDA 发布今年第一批首仿批准清单】。根据这份清单,到 4 月 26 日为止,FDA 仿制药办公室(OGD)共批准了 43 个首仿药。
FDA 指出,“首仿药”的定义正如其名,是...
|

|
真实世界证据支持申请批准的时代已经到来?
2019.05.20
美国 FDA 于 5 月 8 日发布指南草案《向 FDA 提交使用真实世界数据和真实世界证据的药品和生物制品文件》,表示将跟踪在研究用新药申请(IND)、新药申请(NDA)或生物制品许可申请(BLA)下或在批准后提交的真实世界证据(RWE)申报材料,希望申办人使用简单、统一的格式来识别真...
|

|
FDA 新全球办公室将在决定贸易政策方面发挥更大作用
2019.05.18
美国 FDA 新的全球政策和战略办公室(OGPS)正在将 FDA 的业务范围扩展到传统上不属于其管辖的领域(例如,贸易),同时增强美国对全球公共卫生威胁的应对,并提升与其他监管机构之间互认协议的重要性。
FDA 新的政策、立法和国际事务办公室(OPLIA)副局长 Anna Abram 于 5 ...
|
|
【专栏】从美国疫苗监管历史中学习什么?
2019.05.16
疫苗作为20世纪最伟大的医学突破之一,从其诞生之日起,尽管得到无数欢呼和希望,但也始终存在争议和恐惧。支持者认为,接种疫苗是预防和控制传染病最有效、最经济的措施;反对者声称,接种疫苗会带来未知的伤害。在疫苗的发展历史上,因生产环节的污染而造成相当大范围人群伤害的悲剧,在...
|

|
FDA 生物可互换性定稿指南重点变化解读
2019.05.14
美国 FDA 于 5 月 10 日公布了备受期待的《证明与参照产品可互换性的考量》定稿指南。识林之前发布了一篇概要性资讯【FDA 生物类似药可互换性指南定稿 2019/05/11】。随后识林对定稿指南与 2017 年 1 月的指南草案做了花脸稿详细对比,并总结了一些有用且重大的变化列举如下...
|
|
FDA 生物类似药可互换性指南定稿
2019.05.11
自 2015 年首个生物类似药获得美国 FDA 的批准以来,生物类似药的使用及其在市场上的应用方面的问题一直是讨论焦点。FDA 于 5 月 10 日发布了一份业界期待已久的定稿指南 —《证明与参照产品可互换性的考量》,指导企业如何证明生物类似药与其参照许可产品的可互换性。
该指南定稿...
|

|
加速审批药品的广告或将受到特殊监管
2019.05.09
【编者按】药品作为一种特殊商品,经批准的标签/说明书是其特殊性的关键部分,广告作为标签形式的一种,同样为 FDA 所监管。药品广告分为两类,一类是面向医疗卫生专业人员的广告,这类广告的受众有专业的知识和经验,而另一类则是直接面对消费者(DTC)的广告,这类广告的受众通常是...
|
|
印度仿制药获 FDA 批准数据一瞥
2019.05.08
昨日印度时报(the Times of India)商业版上刊登的一篇短小文章颇为有意思,或许能帮助大家从另一个角度更深入地了解仿制药业目前的形势,因为大家并不经常能看到这些统计数据。文章概述了印度制药公司获得的批准数量以及警告信数量。
印度时报文章中的数据是基于财政年度(请注意...
|

|
美国年度特别301报告强调中国和印度的假药问题
2019.05.07
美国贸易代表办公室于 4 月 25 日发布年度《特别 301 报告》,强调假药问题日益严重,并重点提及中国和印度。
《特别 301 报告》(Special 301 Report)是美国对其全世界贸易伙伴国的知识产权保护和执法状况的年度审查报告,由美国贸易代表办公室(USTR)按照美国《1974 年贸...
|

|
FDA 药品中心主任再谈新药审批现代化
2019.05.04
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 于 5 月 2 日在食品和药品法律研究所(FDLI)年会上再次重点介绍了新药审批改革举措,表示 FDA 将在未来两年内实现以现代化的方法审评新药申请(NDA)和生物制品许可申请(BLA)。这已经不是 Woodcock 第一次谈论这一议...
|

|
FDA 推出新网页预告复杂产品 BE 指南的发布
2019.05.02
美国 FDA 昨天推出了新的网页“即将颁布的针对复杂药品研发的具体产品指南”。新网页提供了有关 FDA 在未来一年内针对复杂产品计划发布的新的或修订具体产品指南(product-specific guidances,PSG)。FDA 表示,该网页上的信息将有助于仿制药公司更好地规划复杂仿制药的开发。
背景...
|
|
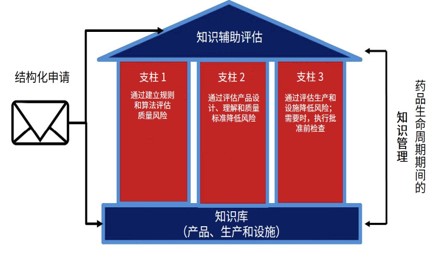
KASA — 面向21世纪的药品评价模式
2019.04.29
两周前在美国马里兰举行的PQRI大会上,FDA药品质量办公室副主任余煊强博士正式向业界宣布了面向21世纪的FDA药品评价(assessment*)新倡议:KASA(Knowledge-aided Assessment and Structured Application,之前翻译为知识辅助评价和结构化申请,余煊强博士建议翻译为智能评价和结构...
|

|
IPEM 美国仿制药研发课堂问答一瞥
2019.04.27
时间:4月11日至14日
地点:IPEM课程 — FDA仿制药法规与产品研发的课堂上
人物:Garth Boehm博士和IPEM学员
学员 1:老师,与原研的处方相比,仿制药的处方有没有可以接受的波动范围?例如,原研API为10g,仿制药API的含量波动范围是95-105%,两者处方没有达到100...
|

|
工业界要求 FDA 进一步澄清竞争性仿制药指南草案
2019.04.24
辉瑞、Perrigo、Teva、Apotex 等公司以及美国普享药协会(AAM)都要求美国 FDA 对竞争性仿制药(CGT)认定和 CGT 专营权指南草案做出进一步澄清。
CGT 认定旨在激励企业开发仅有很少或没有竞争的药品的仿制药。到目前为止,FDA 已经许可了超过 100 多份 CGT 认定请求,并于 201...
|

|
ICH 公开寻求非营利机构的培训合作
2019.04.22
为加快指南的全球实施,ICH 发出呼吁,希望经认可的非营利性组织向监管机构提供 ICH 指南培训。
全球制药商和主要工业化国家于 1990 年组建了 ICH,以协调全球监管方法,现在欠发达国家正在努力希望自己能够达到统一的监管方法,但这些国家的监管机构急需培训。ICH 希望与一个或...
|
|
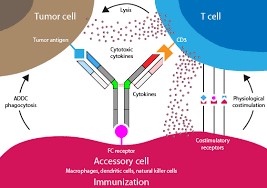
FDA 发布双特异性抗体研发项目指南草案
2019.04.20
美国 FDA 于 4 月 18 日发布《双特异性抗体研发项目》行业指南草案,目前有超过二十多家公司在开发双特异性抗体,癌症治疗的下一个前沿可能涉及这些基因工程重组抗体,这就是 FDA 现在发布指南草案的原因之一。
双特异性抗体是基因工程化的重组抗体,由两个不同的结合结构域组...
|

|
美最高法院驳回 Allergan 公司利用原住民部落保护专...
2019.04.19
美国最高法院驳回了 Allergan(艾尔建)公司通过将专利转让给美国原住民部落来保护最畅销药品专利的做法。
最高法院完整保留了去年 7 月份联邦上诉法院的裁决,裁决维持原判,即,美国专利审判和上诉委员会有权决定 Restasis(丽眼达)眼用治疗产品 6 项专利是否有效。Allergan ...
|

|
FDA 代理局长首次面向全体工作人员演讲
2019.04.18
新上任的美国 FDA 代理局长 Norman Sharpless 计划继续在其前任 Scott Gottlieb 的政策议程上取得积极进展。虽然他现在以代理局长的身份开展工作,但 Sharpless 明确表示他在局长这个职位上不会像临时替补那样得过且过。
4 月 16 日第一次面向全体 FDA 工作人员的演讲中,Sha...
|