
|
FDA 最终决策多大程度上会听从咨询委员会建议?
2019.07.20
随着美国 FDA 正在努力应对越来越大的新药批准压力,最近发表的一项新的研究发现,仅在较少情况下,FDA 的行动会与咨询委员会的建议出现分歧,并且与批准新产品或现有产品的新用途相比,在药品安全问题上更容易出现分歧。
根据1972年联邦咨询委员会法(FACA)实施的咨询委员会(Advisory...
|

|
英国医学杂志刊文:多数新药无新益,监管审批过宽
2019.07.18
德国卫生技术评价机构最近发表在《英国医学杂志》(BMJ)上的一篇分析发现,大多数新批准的药实际上与标准治疗没有太大区别,并呼吁对药物开发和批准进行国际化政策改革。
德国医疗质量与效率研究所(IQWiG)审查了 2011 年至 2017 年间的 216 个新批准 — 152 个新分子实体和 ...
|

|
FDA 和 USP 就小分子专论更新展开合作加速仿制药批...
2019.07.15
美国 FDA 于 7 月 10 日发布新的指南草案《使用 USP 待审专论程序协调药品申请批准的药典标准》,鼓励需要提请对官方 USP 专论做变更的简化新药申请(ANDA)申办人充分利用 USP 的待审专论程序(Pending Monograph Process,USP-PMP),该指南草案是 FDA 持续支持药品竞...
|

|
口服固体缓控释制剂专题青岛会议(第二轮通知)
2019.07.13
高端制剂暑期论坛
口服固体缓控释制剂专题青岛会议
第二轮通知
2019年8月3 - 4日
青岛海泉湾皇冠假日度假酒店
主办单位:北京大学药物信息与工程研究中心
承办单位:青岛百洋制药有限公司
支持单位:上海安必生制药技术有限公司;北京宽见科技有限公司
...
|
|
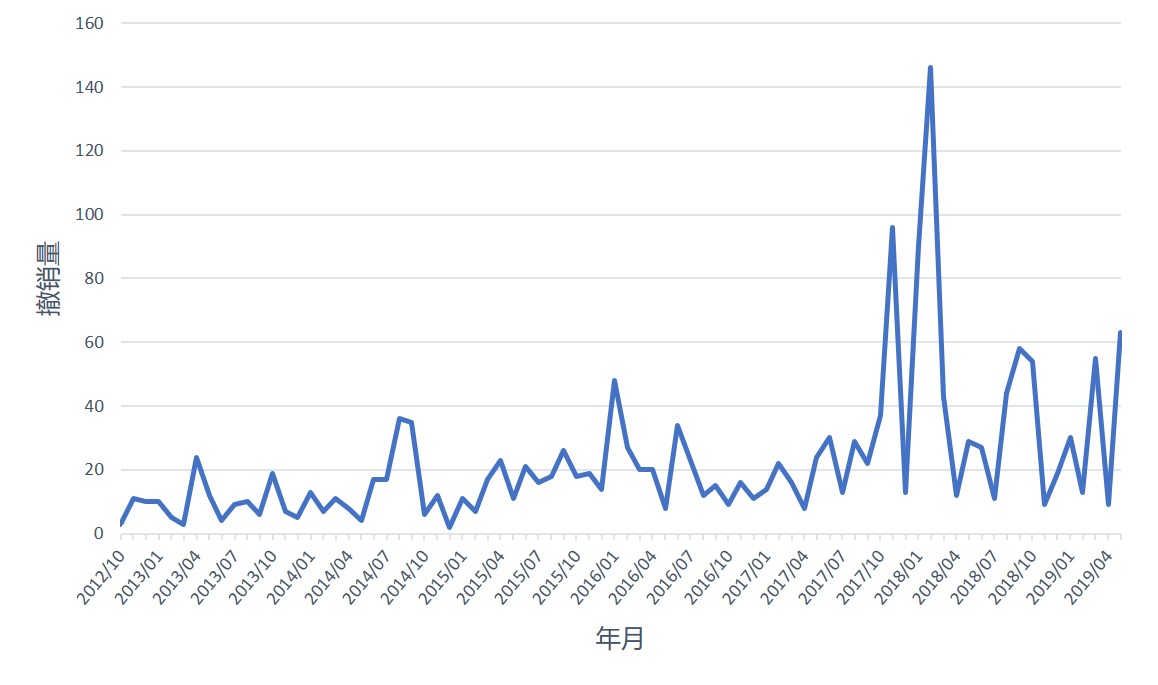
制药商竞相撤销在美仿制药申请?
2019.07.10
2019 财年,企业继续以高比率撤销在美仿制药申请(ANDA),使得仿制药行业的变化再次受到关注。
根据美国 FDA 仿制药计划行动报告的最新数据,2019 财年截至五月份申办人已经撤销了 252 件原始 ANDA。结合 2018 财年 606 件撤销的记录,GDUFA II 期开始不到两年的时间内,...
|

|
FDA 综合审评文件瘦身,大大减少公开信息体量
2019.07.08
美国 FDA 于 6 月 27 日公布了两份综合审评(integrated review)文件样本,展示了其新提出的上市申请综合审评流程和文件模板,这是 FDA 于两年前提出的新药监管计划现代化的一部分。【FDA 药品中心主任再谈新药审批现代化 2019/05/04】FDA 认为,“新的综合审评的格式和内容将...
|

|
FDA 发布两份新指南帮助制药商编写清晰一致的标签
2019.07.03
美国 FDA 于 7 月 1 日新发布两份标签指南文件草案,一份题为《使用说明 — 人用处方药和生物制品以及药械和生物制品-器械组合产品患者标签 — 内容与格式》(用于标准化标签的使用说明部分),另一份题为《人用处方药和生物制品标签的药物滥用和依赖部分》。另外,FDA 表示,...
|

|
FDA 将允许按药品获批的生物制品继续参考 DMF
2019.07.02
美国生物制品转换规定将改变最初在新药申请下获批的胰岛素和一些其它蛋白质产品的监管框架。《2009 生物制品价格竞争与创新法案》第 7002(e)(4) 节要求,在 2020 年 3 月 23 日,生物制品的所有新药申请(NDA)将根据《公共卫生服务法案》(PHSA)第 351 条“视为许可(deemed to ...
|

|
USP 基于风险的快速微生物检测
2019.06.27
美国药典(USP)《无菌短效期产品的快速微生物检测:一种基于风险的方法》将于年底生效,一些读者对于这方面的内容多有关注,识林对于该章节内容翻译如下,供读者参考,具体内容还请查阅 USP 原文。
无菌短效期产品的快速微生物检测:一种基于风险的方法
介绍
人们普遍认为,目...
|

|
FDA 开始构建制药行业研发活动预测工具
2019.06.26
为改善招聘需求、资源分配和使用者付费的计算,美国 FDA 正试图预测整个制药行业的药物开发活动。
FDA 药品审评与研究中心(CDER)计划与战略分析办公室资源能力规划团队主管 Josh Barton 于 6 月 7 日在 FDA 关于使用者付费计划财务管理和透明度的公开会议上表示,使用内部 F...
|

|
美国生物药是否真的需要 12 年市场专营权?
2019.06.24
人们普遍认为生物药由于其复杂性,开发过程耗时且昂贵。因此《生物制品价格竞争与创新法案》规定生物药的专营权期限为 12 年。相比之下,Hatch-Waxman 法案规定新分子实体专营权为五年。但 6 月 18 日发表在《自然 – 生物技术》(Nature Biotechnology)上的一项研究通过分析...
|

|
FDA 公开表示 USP 生物制品标准阻碍创新
2019.06.22
美国 FDA 的主要官员公开发文表示 FDA 对于美国药典(USP)生物制品药典标准的立场并做出解释,认为 USP 生物制品药典标准对于确保安全和质量并不会提供额外保证,并且可能会给审评人员和行业增加负担,减少竞争,限制创新。
美国药典会正在反对一项参议院拟议法案,该法案规...
|

|
FDA 第IV段专利声明清单包含新数据以促进仿制药竞争
2019.06.20
美国 FDA 于 6 月 18 日表示,在决定是否提交仿制药申请时,仿制药申请人将从 FDA 获得更多信息,这可能会增加早期批准的可能性。
过去,清单仅包括药品名称、剂型、规格、参照上市药品(RLD)/新药申请(NDA)号,以及向 FDA 提交包含第 IV 段声明的首份实质完整的仿制药...
|

|
拖延仿制药批准、公民请愿与监管透明度
2019.06.19
为拖延仿制药(ANDA,505(j))、改良药(505(b)(2))和生似药(351(k))的注册审批,原研药公司可以向美国FDA提交公民请愿(citizen petition),引证如生物等效或其它安全性问题,提出FDA应拒绝批准某注册申请。收到请愿后,FDA有150天时间决定是否接受该请愿。若是请愿在FDA即...
|

|
口服固体缓控释制剂专题青岛会议(首轮通知)
2019.06.12
高端制剂暑期论坛
口服固体缓控释制剂专题青岛会议
第一轮通知
2019年8月3 - 4日
青岛海泉湾皇冠假日度假酒店
主办单位:北京大学药物信息与工程研究中心
承办单位:青岛百洋医药股份有限公司
支持单位:上海安必生制药技术有限公司;北京宽见科技有限公司...
|

|
FDA 使用机器学习建模预测 ANDA 申报
2019.06.08
美国 FDA 研究人员 4 月 22 日在线发表在《临床药理学和治疗学杂志》上的一篇文章指出,利用药品、监管和药物经济学信息可以准确地预测新化学实体的首个简化新药申请(ANDA)申报的时间。这种建模方法可以帮助 FDA 优化其在仿制药使用者付费(GDUFA)计划下的资源分配和工作量,并...
|

|
微生物治疗药物:制造方面的挑战
2019.06.07
随着对专门选择或设计用于治疗疾病的细菌越来越多的关注和希望寄托,开发这类微生物药物的公司可能会遇到有可能花费数百万美元或减缓其进展的障碍。障碍是什么?微生物药物的制造问题。
微生物药物是指利用正常微生物或调节微生物正常生长的物质研制而成的药物制剂,包括粪便菌群、活体...
|

|
FDA 将于今年发布或修订的法规一览
2019.05.31
美国联邦政府每年两次发布https//www.reginfo.gov/public/do/eAgendaMain 《联邦监管和去监管化行动统一议程》,为美国公众提供对整个联邦政府正在制定或审查的法规的深入了解。2019 年春季的统一议程中关于美国 FDA 的部分,概述了 FDA 在 2019 年“希望”或“考虑”发布...
|
|
简谈新版 USP 光谱鉴别要求变化带来的问题
2019.05.30
新版《美国药典-国家处方集》(USP 42 -NF 37)于今年 4 月 30 日生效之前,USP 章《光谱鉴别检测》规定,“物质的红外(IR)吸收光谱与相应 USP 参照标准品相比,提供可能是任何单一检测中实现物质鉴别的最为确凿的证据。”该章节表示可以对样品和标准品同时分析,并通过比较...
|

|
ICH 将于近期发布和起草的指南一览
2019.05.28
美国 FDA 于 4 月 29 日上午与加拿大卫生部联合举办了 ICH 公开咨询会议,简要介绍了十几份不同 ICH 指南的进展和可能的预期。
在这个持续三小时的会议上,三位 FDA 专家和北卡罗来纳大学生物统计学教授 Lisa LaVange 讨论了近期进入 ICH 流程第 3 阶段的指南主题。F...
|