
|
设施和辅料信息缺陷是 ANDA 在美国审评延迟的主要原...
2018.03.04
DMF隐藏设施会延迟ANDA审批
FDA 仿制药办公室最近在提醒ANDA申请人,确保在356h 表格和CTD模块3.2.S.2中提交了“原料药和药品生产、包装和检验的所有设施的当前信息”。
仿制药办公室(OGD)已经强调了在审评中发现的设施问题频率,有些设施参与了生产工艺但却未在申报资料中,...
|

|
FDA局长誓言处理药品价格昂贵和制药商的“制度博弈”
2018.03.02
Sarah Jane Tribble,Liz Szabo, Kaiser Health News Service 02/15/2018
FDA局长Scott Gottlieb表示,他将尽一切力量,“在职权范围内”对抗昂贵的药品价格,他认为制药公司在市场上以多种方式“通过制度博弈来阻止竞争”。
在Kaiser Health News范围广泛的采访中,Got...
|
|
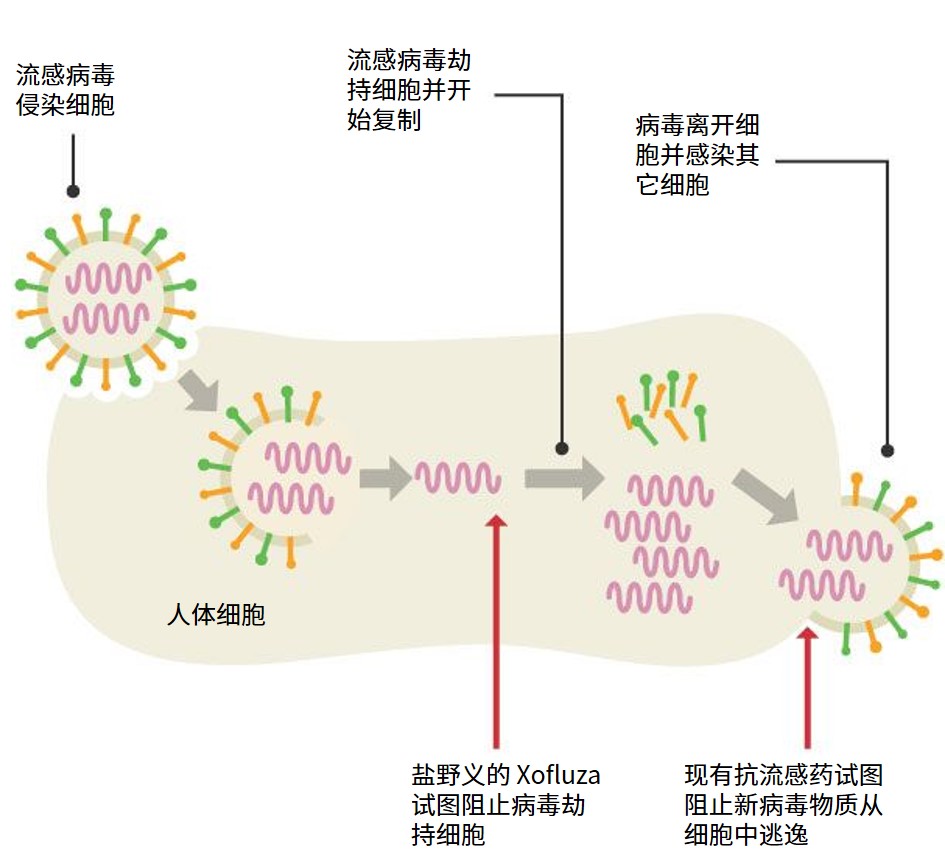
日本批准 Xofluza 可在一天内清除流感病毒
2018.02.24
日本批准一款新型抗流感药,其制造商表示可在 24 小时内杀死流感病毒,卫生专家认为这可能是流感疾病治疗方式方面的重大突破。
2 月 23 日,日本盐野义制药的 Xofluza 获得日本卫生部的快速批准。但据公司发言人表示,由于国家保险尚未确定价格,因此五月份之前可能无法在日本提...
|

|
FDA 希望预测企业对 ANDA 完全回应函的回复
2018.02.23
正如行业希望在仿制药评估中增加更多确定性一样,美国 FDA 对行业的反应也希望有更多确定性,即申办人何时或者是否将处理在完全回应函中确定的问题。
根据 1 月 10 日召开的仿制药使用者付费计划实施会议的会议纪要,行业和 FDA 官员讨论了,ANDA 完全回应函(CRL)发布后,“...
|

|
FDA 与业界对 ICH Q12 中基于性能的已建立的条件...
2018.02.22
制药行业人员对于在国际协调理事会(ICH)关于批准后变更的 Q12 指南中列入基于性能(performance-based )的已建立的条件(established conditions,EC)表示支持。这种方法使制造商在对已获批产品做生命周期生产变更时有更大灵活性,而无需事先获批监管机构的批准。
美国 FDA ...
|

|
FDA 发布五篇具体疾病指南推进神经系统疾病新药研发
2018.02.21
美国 FDA 于 2 月 15 日发布了五篇关于神经系统疾病药物研发的新指南,展示了 FDA 监管方法的几个变革的方面,从如何与患者合作到如何组织编写文件。
FDA 局长 Scott Gottlieb 在同一天https//www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm596897.htm?utm_campaign=0...
|

|
FDA 计划使用 2019 财年资金预算开展的新举措
2018.02.20
根据美国卫生与人类服务部文件,在美国总统特朗普的 2019 财年预算请求中,FDA 将获得 58 亿美元的预算,比 2018 财年持续解决方案资金中的年化水平增加了 6.63 亿美元。总体资金增长将近 13%,远高于近年来的增幅,与特朗普在其 2018 财年预算审评中的资金战略相比出现大幅逆...
|

|
FDA 发布药物共晶的监管分类定稿指南
2018.02.16
美国 FDA 于 2 月 14 日发布关于药物共晶的监管分类的定稿指南。该指南旨在阐明如何对共晶进行分类,以及新药申请(NDA)和简化新药申请(ANDA)的申办人应提供哪些信息以支持共晶的分类。
FDA 将药物共晶定义为“共晶是由两种或更多不同分子,通常是药物成分和共晶形成物(coform...
|

|
FDA 药品中心主任评议仿制药评估新范式
2018.02.15
2 月 14 日的普享药协会(AAM)年会上,美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 就有关在不远的将来开展的仿制药申请新评估方式给了仿制药申请人一些希望。评估新体系的目标是改善审评过程的效率和有效性。为什么这种改变是必要的?Woodcock 承认,随着递交给 F...
|

|
美总统预算提案中对 180 天专营权的改变引发业界担...
2018.02.14
美国总统特朗普计划提议修改 Hatch-Waxman 法案中的仿制药专营期条款,以便压缩首个仿制药在市场上面临竞争对手之前的时间。180 天专营权将会从第二个 ANDA 可批准之时开始计算,而不是在首个仿制药上市之时,如果这一变化得以实施,将可能是对 Hatch-Waxman 法案框架的重大改变。
...
|

|
研发和生产质量管理团队,哪个作为技术转移主导方更好
2018.02.13
研发和生产质量管理团队,哪个作为技术转移主导方更好
—“南京卓康医药杯”第三期IPEM学员知识辩论赛小记
IPEM2017级课程期间,举办了第三届IPEM学员知识辩论赛,题为:研发和生产质量管理团队,哪个作为技术转移主导方更好?
正方:由研发团队主导更好,尹放东老师任导师,四...
|

|
FDA 发布 2018 - 2022 财年数据标准战略
2018.02.12
美国 FDA 药品和生物制品中心于 2 月 5 日发布了他们在未来五年内选择、开发和实施数据标准的共同战略。
具体而言,战略概述了 FDA 药品审评与研究中心(CDER)和生物制品审评与研究中心(CBER)对于使用数据标准的治理框架和目标。“两个中心将共同利用其综合资源、人才和专业...
|

|
未能向 FDA 提交一次性市场状态报告的制药商将面临...
2018.02.11
美国 FDA 连续敦促制药商提交关于已上市产品的强制性一次性报告。作为《2017 FDA 重新授权法案》(FDARA)的一部分,申办人必须对橙皮书中列出的所有已获批产品提交一次性市场状态更新。截止日期为 2 月 14 日,法案颁布后 180 天。
FDA 给出的暗示似乎是:“不要等到截止日...
|
|
FDA 发布 35 篇新 BE 指南和 22 篇修订指南
2018.02.09
美国 FDA 于 2 月 8 日发布了 57 篇具体产品生物等效性(BE)指南,35 篇新增,22 篇修订。其中包括 19 篇复杂仿制药的指南。
我们之前曾经发布过关于修订后的 BE 指南的影响,现在又有 22 篇指南需要企业审查以确定任何 BE 建议的变化是否意味着更多工作或重复研究...
|

|
2017:美国仿制药又一创纪录的年份
2018.02.08
(翻译自 FDA Voice “https//blogs.fda.gov/fdavoice/index.php/2018/02/2017-was-another-record-setting-year-for-generic-drugs/ 2017 Was Another Record-Setting Year for Generic Drugs” 2018 年 2 月 8 日,作者:Kathleen “Cook” Uhl,医学...
|

|
FDA 发布关于申请人何时提交元素杂质数据的指导
2018.02.07
美国 FDA 仿制药办公室(OGD)要么听到了来自业界的建议,要么主动决定向 ANDA 申请人提供关于处理提交文件以满足元素杂质问题的最佳方式的指导。【元素杂质实施截止日期导致 FDA 仿制药批准下降? 2018/01/20】 OGD 于 2 月 7 日发布了关于“申请人决定何时向 FDA 提交...
|

|
FDA 肿瘤卓越中心一周年记
2018.02.04
(译自 FDA Voice https//blogs.fda.gov/fdavoice/index.php/2018/01/the-one-year-anniversary-of-the-oncology-center-of-excellence/ “The One-Year Anniversary of the Oncology Center of Excellence”,2018 年 1 月 19 日,作者:Richard Pazd...
|

|
数据将如何变革医疗?
2018.02.02
今天,当人们进入富国医疗体系时,他们知道他们会得到什么:匆忙的医生、无休止的检查、困惑的行话、上涨的费用,以及最重要的是,长久的等待。总是需要一些忍耐,因为医疗是复杂和谨慎的事情。但是这种挫败感已经鼎沸。本周,美国三大商业巨头亚马逊(Amazon)、Berkshire Hathaway 和...
|
|
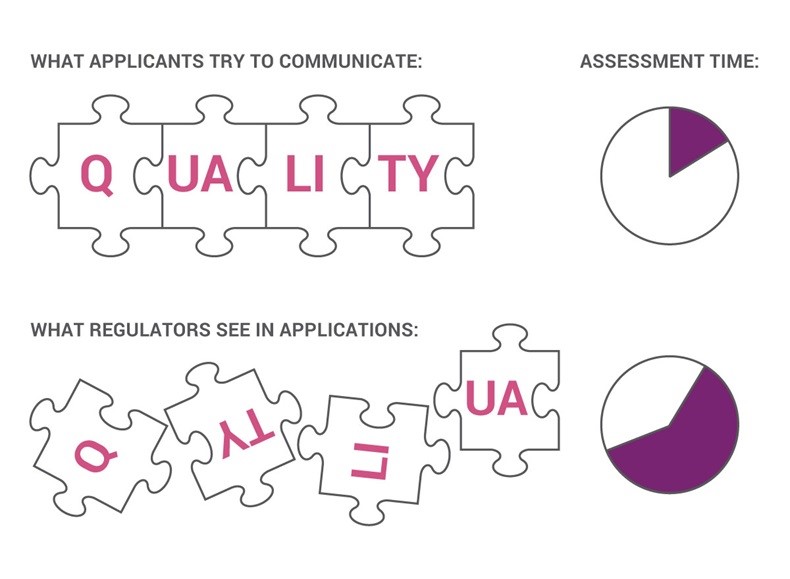
FDA 倡导改进申报资料中的质量综述内容
2018.02.01
美国 FDA 希望通过要求申办人更好地利用通用技术文件(CTD)的质量综述,加快 NDA 和 ANDA 审评并为最终 ICH 的采纳奠定基础,CTD 质量综述可以使 FDA 审评人员关注患者影响和其它关键因素。
美国 FDA 邀请制药企业探索使用质量综述(QOS)的新方法,以加强和加快新药和仿...
|

|
美国仿制药行业将迎来新的非营利性成员?
2018.01.31
最近美国仿制药行业将有一位新成员进入的消息引起了很大反响,但却并没有很多关于这一新成员计划如何运营的信息。据 https//www.drugstorenews.com/pharmacy/new-generics-company-emerges-unlikely-source/ Drug Store 新闻网报道“不久将有一家新的仿制药制造商出现,一家...
|