
|
505(b)(2)申请比新分子实体申请需要更长审评时间
2017.04.18
根据 Tufts 药品研发研究中心(CSDD)与 Sakai 监管咨询公司的分析,美国 FDA 的 505(b)(2) 新药申请(NDA)路径 — 一种最常用于现有药品的新剂型和新配方的简化程序,并不会缩短审评时间。
2017 年 3 月/4 月的 Tufts CSDD 影响报告建议,虽然 505(b)(2) 路...
|

|
EMA发布胃肠道局部用药BE决策树
2017.04.17
2017年4月4日,EMA发布了一篇针对胃肠道系统局部用药的等效性研究指导原则,有4个章节分别介绍口腔/咽喉、胃、肠、直肠局部用药;明确了豁免临床试验的情况、如何进行体内生物等效性。
指导原则的名称为:胃肠道系统局部作用产品的治疗等效性证明的等效性研究指南草案,含已知成分的局...
|

|
国际药物工程管理(IPEM)课程教育班5月课程预告
2017.04.16
产业化方向
课程一:质量管理体系
授课老师:Blair Okita
授课方式:中英文交传
上课日期:4 月 27 - 28 日
老师简介:
Blair Okita 博士现任 Merck 全球生物制药质量高级副总裁,负责 Merck 生物制药部门制造和销售的所有药品和医疗器械产品(商业化和临床...
|

|
GDUFA II 期年度项目费估算
2017.04.14
美国 FDA 于 4 月 11 日公布了正在收集的已获批申请持有人的现有数据,这些数据可以供我们估算三个层级的项目费(program fee)金额。虽然根据我们过去所做的大概估算来看并没有太出乎意料,但预估的收费标准可能会令在中等和大企业层级的某些企业有些震惊。此外,有一张表列出了首次拥...
|

|
多少种药物可以基于BCS豁免BE?
2017.04.13
CDER 已经分析了 55 种药物(drug subsance)制备的IR口服固体制剂,基于申请人递交的数据,认为其中的 41种 适合基于 BCS 的 BE 豁免。41 种药物中的 4 种(约 10%)是癌症治疗药。 相比之下,在 WHO 药品标准专家委员会第 40 次技术报告(WHO TRS 937 Annex 8)中,...
|

|
BE 的监管考量与发展趋势
2017.04.12
现有体外溶出方法的由来和作用是为同一药品不同生产批次提供质控,而非预测不同药品间的生物等效性( BE) 。研发具有BE预测性的溶出方法是FDA积极支持的科学探索。
良好的BE 设计应基于对药品作用机制和特性、法规要求及其科学理性的考量、及统计学方法功效和适用条件等的深入和系...
|

|
FDA推迟对药物主文件的eCTD要求
2017.04.09
美国 FDA 于 4 月 7 日发布修订版指南《以电子形式提交申请 – 部分人用药品和相关申请采用eCTD质量标准》,将对药物主文件(DMF)和生物制品文件(BPF)以 eCTD 格式提交的要求推后一年,延迟至 2018 年 5 月 5 日实施。
其它文件,例如新药申请(NDA)、简化新药申请(A...
|

|
FDA发布报告总结监管科学方面的成就
2017.04.08
美国 FDA 的监管行动通常广受关注,而 FDA 在推动医药产品研发和制造方面的努力却少受注意。FDA 于 3 月 29 日发布的《2015 – 2016 财年:监管科学进展报告》发布的第二份进展报告。
FDA 表示,“FDA 的机构内研究项目范围广泛,其研究合作涉及数百个合作机构。这份报告无...
|

|
【专栏】一文读懂 FDA 仿制药年度报告
2017.04.06
美国 FDA 一年一度的仿制药论坛(Generic Drugs Forum)刚刚结束,两天的会议中二十余位 FDA 官员围绕仿制药申请、检查、收费等各方面的问题进行了政策宣讲。药品审评与研究中心(CDER) 的两位超级办公室主任 — 仿制药办公室(OGD)主任 Kathleen Uhl 和质量办公室(OPQ)主任 Mich...
|

|
提交日期重新出现在FDA批准函中
2017.04.04
自我有记忆以来,ANDA 的提交日期就在申请的批准函中报告。但这一做法在 2016 年初终止了。申请的提交日期是帮助企业跟踪申请批准时间的重要指标。当申请提交日期在批准函中消失时,我们听到了许多企业的抱怨。仿制药贸易协会甚至提出这一做法使得仿制药计划进一步缺乏透明性。【ANDA批...
|

|
EMA发布统计学方法在质量比较评价中应用的思考性文件
2017.04.03
欧洲药监局(EMA)于2017年4月1日发布了《统计学方法应用于药品开发中质量属性比较评价的思考性文件草案》,并向业界征求意见。文件主要讨论了质量属性比较中的统计学问题,特别是在生产变更前后质量对比、生物类似药质量对比和仿制药溶出对比中面临的挑战,希望引发各界讨论,最终建立质...
|

|
从利福昔明BE指南修订看FDA对Q1Q2价值的认可
2017.03.28
美国 FDA 仿制药办公室(OGD)修订了其关于利福昔明 200 mg 和 550 mg 片剂的生物等效性(BE)建议。相当有趣的是,对于产品与参照药品(RLD)定性和定量(Q1/Q2)相同的产品, BE 要求将减负,并可能取消开展临床终点生物等效性研究(尽管仍需要药代动力学PK研究和体外检测。)...
|

|
FDA 再生医学先进疗法认定路径开启
2017.03.27
Humacyte 公司于 3 月 20 日凭借其研究性人用无细胞血管 Humacyl 似乎成为获得美国 FDA 再生医学先进疗法(RMAT)认定的首家公司。
目前看来 RMAT 认定最初推出的过程中,FDA 正迅速地通过认定请求。Humacyte 发言人表示,FDA 为申请做出了“快速响应”。“我们相信这显...
|

|
FDA-PQRI会议上报告的ICH Q12 进展更新
2017.03.26
3 月 22 - 24 日第三届 FDA/PQRI 先进产品质量会议在华盛顿召开,来自监管机构、企业、大学、行业协会和咨询机构共约200余人参会。会议重点话题之一就是 ICH Q12 《药品生命周期管理的技术和监管考虑》指南的进展以及在技术和监管上的全球协调统一情况。
葛兰素史克全球 CMC 战略...
|

|
BE试验怎么做?如何审? - 有体内预测力的溶出方法
2017.03.22
“我们研究所只负责体外研究,保证体外四条曲线一致,BE试验由企业自行开展。”
“我们开发的是有体内预测力的溶出方法,保你BE试验顺利通过,通不过全额退款。”
“第一次预BE通不过,费用企业承担,第二次预BE通不过,双方各承担50%,第三次…….”
“基地现在试验床位很紧张,要...
|

|
印度药业在质量方面的进取
2017.03.20
【编者按】众所周知,印度药厂先于中国药厂陷于数据可靠性困境。但印度药业整体做了什么呢?请看印度药协会上月发布的长达112页的数据可靠性指南的首段:“印度药协会于2015年创立了质量论坛(Quality Forum),用以帮助印度药厂在质量上与全球接轨。印度药业承诺启动数年的征程来解决...
|

|
美国医疗花费激增有多少责任在审批?
2017.03.19
现在美国几乎所有与健康相关的头条都提及费用。无论是医疗保险费用、住院费用、医生费用还是药费。虽然有一些令人震惊药品花费,但大多数都是符合预期的。最大的问题之一是,即使是一些中等价格的药品,如果这些药没有被使用,那么将会是最为昂贵的药。并且事实上,如果患者住院了,那么整...
|

|
FDA 2017财年2月ANDA批准和接收数据
2017.03.18
美国 FDA 仿制药办公室(OGD) 2017 年 2 月份共批准 61 件 ANDA,非常接近月度新药和仿制药批准网站报告的 60 件的数量。这是过去许多月份中看到的批准量差异最小的一个月。OGD 还发布了 11 件暂时批准(TA),故 2 月份共有 72 件批准行动。如果依据本财年过去五个月的批...
|

|
美总统预算提案公布,引发医药界一片哗然
2017.03.17
美国总统特朗普于 3 月 16 日公布其 2018 财年预算蓝图 — “American First – A Budget Blueprint to Make America Great Again”,称之为蓝图,仅包括较为概览性的内容并且看起来之后很可能会修改,更多预算细节可能会在接下来几周公布。
预算提案中要求增加来自企...
|
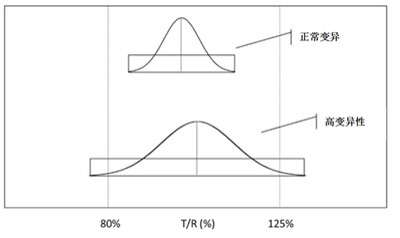
|
BE试验怎么做?如何审? - 高变异药物
2017.03.16
“预 BE 试验已经做到 18 例,受试者多一些才保险。”
“药物变异性高,已做到 120 多例,若再多一些例数就通过了,听说有企业这个产品都突破 150 例了。”
“这个是我们企业的主打产品,钱不是问题,多增加受试者,务必确保通过。”
“这个药物变异性太高,我们床位有限,一...
|