|
首页
>
资讯
>
FDA 表示 2021 财年检查数量远超预期
出自识林
2021-11-24
美国 FDA 于 2021 年 11 月 22 日更新了《FDA 检查监督弹性路线图》,表示其在 2021 财年下半年进行的国内监督检查数量是最初在春天发布的路线图中预测数量的两倍多。
在最初路线图中,FDA 估计在 2020 财年和 2021 财年计划完成的 15,000 多项国内监督检查会因大流行而被推迟,其中在基本情况下可以执行约 14% 的检查,进而逐步过渡到正常运行水平。
FDA 指出,“这包括 12,285 次人用和动物食品国内监督检查中的 1,272 次(10%),以及 3,229 次未完成的人用和动物用医药产品检查中的 851 次(26%)。”FDA 表示,其现在已经超过了这些预期以及对更快过渡到正常运行的预测,已完成的检查数量是之前估计的两倍多。FDA 预计到 2021 财年末可以执行 2,213 次检查,但 FDA 已经设法执行了 4,849 次检查(见下表)。
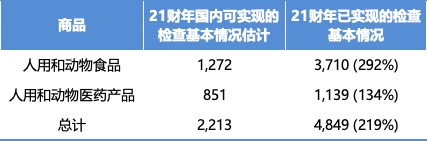 FDA 表示 2021 财年检查数量远超预期.jpg ]] FDA 在更新的弹性路线图中写道,“截至 2021 年 9 月 30 日,FDA 已经超过 2021 财年基本情况预测,完成的国内监管监督活动是路线图中预测的两倍多。FDA 开发新的监督方法并扩大使用各种监督工具,极大地促进了 FDA 超越这些目标的能力。这使 FDA 能够对尽可能多的设施进行监督,同时利用资源保护消费者和患者并促进公共卫生。”
FDA 还注意到在进行批准前检查方面取得的进展,这在大流行初期就引发了行业的关注。FDA 在发布最初的路线图时表示,有 68 件医药产品申请“仅因等待检查或设施评价而延迟”,其中 7 件被认为是关键任务。“截至 2021 年 9 月 30 日,FDA 进行了检查或设施评价以支持其中 30 件延迟申请的决定,包括所有 7 件关键任务申请。此外,其中的 5 件申请不再仅仅因为等待检查或设施评价,而是有其它因素导致了延迟。”在此后几个月里,FDA 表示已收到另外 31 件符合优先排序标准的申请,并且已完成对其中 4 件申请的检查或设施评价。
FDA 表示,截至 2021 年 9 月 30 日,有 60 件申请仅因等待检查而延迟。
对于国外检查,FDA 表示继续专注于关键任务检查,不过其在 2021 财年也进行了一些非关键任务检查。FDA 表示,在 2021 年 4 月至 2021 年 9 月期间,在 23 个国家进行了 124 次国外检查,其中 74 次与人用和动物用医药产品有关。
此外,FDA 表示,其在 2021 财年还超越了其合规性跟踪检查的目标。“在路线图中,FDA 报告了截至 2021 年 3 月,我们已经进行了计划在 21 财年进行的 164 次官方行动指示(OAI)后续检查中的 49 次,剩下 115 次以满足我们 80% 的绩效目标。截至 2021 年 9 月 30 日,FDA 执行了 228 次后续检查活动,完成了 21 财年绩效目标的近两倍。大约 75% 接受后续检查的企业在后续检查期间被发现已经实现合规。FDA 正在评估剩余 25% 的企业,以决定是否采取进一步行动。”
作者:识林-蓝杉
识林®版权所有,未经许可不得转载。如需使用请联系 admin@shilinx.com 。
|