
|
FDA 与 IPEM 师生趣谈十年成就
2019.09.28
9月24日上午,FDA与IPEM师生和代表内部交流活动中,北京大学郑强教授代表师生抛出的最后一问:FDA合规监管过去十年最大成就是什么? CDER药品质量办公室下属警戒办公室质量情报、风险分析和建模处主任 Jennifer Maguire打趣说:“最大的成就是雇佣了我”,引起了一番趣谈。
(一...
|

|
不再透明?FDA不顾反对力求减少审评报告公开信息
2019.09.27
美国 FDA 新药办公室(OND)主任 Peter Stein 在 9 月 24 日下午的 RAPS 监管趋同闭幕会上, 向与会人员确认,申办人和其他感兴趣的利益相关方如果希望检索一些当前在 FDA 发布的药品批准文件包中可获得的数据,在新的综合审评(integrated review)计划下将需要通过信息自由法...
|

|
FDA 公布诺华对数据操纵问题的 483 回复
2019.09.26
美国 FDA 于 9 月 24 日公布了 诺华公司在 8 月 23 日提交给 FDA 的有关其基因治疗药数据操纵问题的 483 回复。这份长达 59 页的回复函中指出,由于调查的“高度复杂”性而未能尽快将这一问题告知 FDA,并将问题责任归咎于两名 AveXis 高管。
诺华下属子公司 AveXis 公司...
|

|
FDA 两大中心主任讨论如何克服生物制造创新障碍
2019.09.23
美国 FDA 生物制品中心(CBER)主任 Peter Marks 和药品中心(CDER)主任 Janet Woodcock 在今年 6 月下旬国家生物制药制造创新研究所(NIIMBL)第三次年会上分别做了报告,讨论了制药业制造创新方面的现状与面临的挑战以及如何克服障碍。
Marks 提出,公私合作在推进细胞和基因治疗...
|

|
FDA 推出技术现代化行动计划,向“云”监管转型
2019.09.21
美国 FDA 于 9 月 18 日公布了其技术现代化行动计划(Technology Modernization Action Plan,TMAP),这是其为海量数据申请持续增长做准备并帮助填补科学进步和新疗法之间差距的努力的一部分。
计算机硬件和软件技术的近期现代化是 FDA TMAP 的重点,提供了关于 FDA 需...
|

|
FDA 阻止故意拖延仿制药批准的公民请愿指南定稿
2019.09.20
美国 FDA 于 9 月 18 日发布了《根据联邦食品、药品和化妆品法案第 505(q)节规定的公民请愿和中止行动请愿》定稿指南,指南讨论了 FDA 在确定公民请愿(citizen petition)和中止 FDA 行动的请愿其主要目的是否是推迟未决仿制药(ANDA,505(j))、生物类似药(351(k))或改良...
|
|
欧洲药典更新反映监管和科学进步
2019.09.19
欧洲药典(PhEur)第 10 版于今年 7 月发布,更新反映了欧洲和国际层面的监管变化以及最新的科学和技术进步,以及对仿制药和生物类似药不断增长的需求。在最新版欧洲药典的 114 篇新增各论中,有多篇生物制品各论,包括英夫利昔单抗和通过 rDNA 技术生产的其它药物。还有 17 篇...
|
|
FDA - TCPro 工具模拟生物治疗药物免疫应答
2019.09.18
Scientists at the U.S. Food and Drug Administration (FDA) have developed a mathematical tool that predicts whether the body will produce antibodies that block the activity of biotherapeutic protein drugs.
The computational tool, called TCPro, simula...
|

|
FDA 发布 34 篇新 BE 指南和 19 篇修订指南
2019.09.18
美国 FDA 于 9 月 16 日发布了一批 53 篇具体产品生物等效性(BE)指南,其中 34 篇新增,19 篇修订。
这些指南中包括针对复杂药品的 5 篇新增指南草案和 11 篇修订指南草案。53 篇指南中近半数(8 篇复杂药品和 18 篇非复杂药品)针对的是尚无获批简化新药申请(ANDA)的...
|

|
欧盟制药业质疑 ICH 生物分析方法验证指南
2019.09.16
欧盟的制药企业对于今年 2 月份新发布的 ICH M10《生物样本分析方法验证指南》提出质疑,认为指南“过于宽泛且含糊不清”,如果不做出改变,所有研究、基质和分析物都可能被包含在指南范围之内,给企业增加负担。
欧洲制药工业协会联合会(EFPIA)在 8 月 23 日提交到欧洲药品管理...
|
|
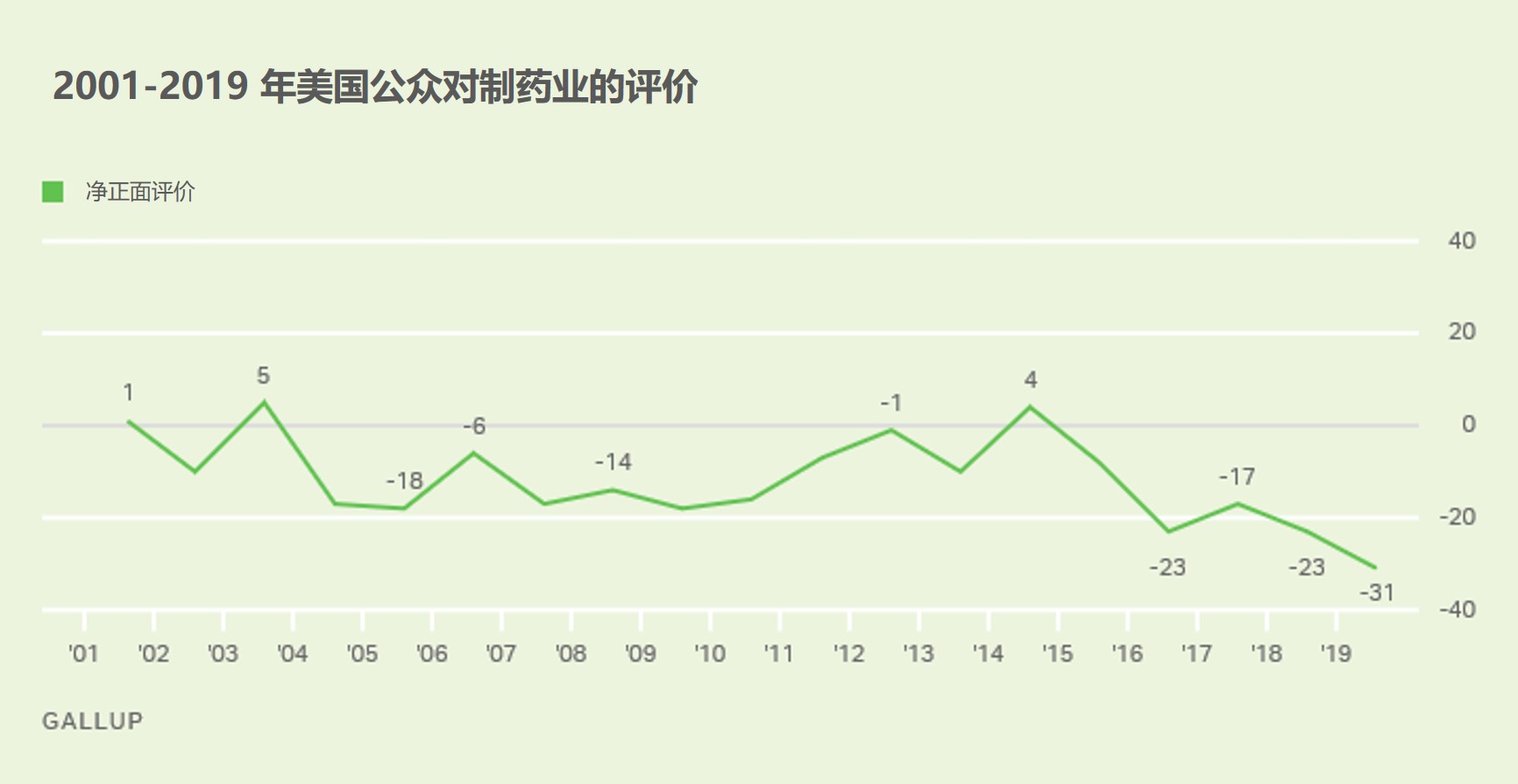
制药业公众形象垫底,医疗卫生业倒数第三
2019.09.14
制药业现在是美国公众眼中最不受欢迎的行业,根据盖洛普(Gallup)民意调查,制药业在其每年调查的 25 个行业中排名垫底。比起三年前倒数第二的排名,制药业的不受民众欢迎程度再创新低。【民众为何对制药业的好感每况愈下? 2016/09/14】美国民众对于制药业给出负面评价的比例达 58...
|

|
谷歌与梅奥诊所联手患者数据和人工智能医疗研究
2019.09.12
9 月 10 日,梅奥诊所(Mayo Clinic)宣布与谷歌展开全面合作,将患者数据存储在谷歌云中,并使用人工智能和其它技术来改善医疗护理。
这项为期 10 年的合作伙伴关系证明了谷歌在美国医疗保健系统中不断扩大的作用与影响,并使梅奥诊所能够更好地获得将其专业知识融入算法和商业...
|

|
FDA 药品中心主任公开抨击当前药品研发体系
2019.09.11
美国 FDA 药品中心(CDER)主任 Janet Woodcock 9 月 6 日在“医疗突破(Breakthroughs in Medicine)”会议上严厉抨击了现在的制药系统。这个系统提供非凡的新药,其中一些可以治愈过去难以治疗的疾病,但价格却远远超出许多患者可承担的范围。
她表示,“(目前的体系)现...
|
|
药品运输验证探讨
2019.09.09
不知大家想过没有:患者与医生或药品经销商之间的最后连结点在哪里?不是负责发药的药剂师而是药品包装。药品包装是至关重要的,此外,在整个药品供应链中,包装可以保护药品免受外部影响和异物侵害,此外,在药品保质期内,包装有助于在各种环境条件下确保药品始终如一的保持产品标签上的...
|
|
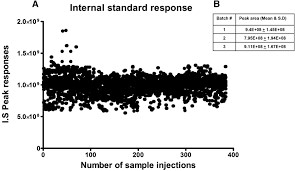
FDA 色谱分析数据中内标响应变异性的问答指南
2019.09.07
美国 FDA 于 9 月 4 日发布了一份问答定稿指南,向申办人、申请人和合同研究组织提供有关色谱分析数据中内标(IS)响应变异性的建议。这份指南由 FDA 药品审评与研究中心(CDER)下的研究诚信和监督办公室、仿制药办公室和临床药理学办公室共同制定。
此类色谱分析数据可能在研...
|

|
2019 IPEM年会
2019.09.05
合理监管 Regulate Sensibly ,科学研发 Develop Scientifically ,高效生产 Manufacture Competitively ,尽责管理 Manage Responsibly
2019 IPEM年会
北京大学中关新园1号楼 科学报告厅 2019年10月17-18日(周四-周五)
鸣谢:IPEM顾孝诚基金,IPEM 课...
|
|
组合产品上市后 CDMO 策略
2019.09.04
组合产品公司应如何监控产品、工艺或监管变化带来的影响?
应采用哪些技术文件和支持程序来开展有效的上市后产品管理?
如何管理诸如纠正和预防措施(CAPA)、投诉和变更控制等上市后问题?谁负责评估这些系统,如何对多个供应商进行管理?
本文针对的是那些已有组合产品上市或者正...
|

|
WHO 启动人类基因组编辑研究全球登记
2019.08.31
世界卫生组织(WHO)于 8 月 29 日宣布启动人类基因组编辑研究全球登记,同时对于人类基因组编辑治理在线征询意见。
WHO 在去年 11 月份贺建奎宣布一对广受争议的基因编辑女婴降生后宣布组建新专家委员会,委员会于今年二月正式成立,于三月份举行了首次会议,呼吁为所有人类基...
|

|
FDA 综合审评文件因丢失大量宝贵信息遭联名反对
2019.08.30
来自哈佛大学、耶鲁大学、约翰霍普金斯大学以及世界其它大学的 50 多名学者和研究人员呼吁美国 FDA 不要用综合审评(integrated review)取代其对医药产品的原始审评,因为综合审评文件将会丢失很多有价值的信息。
FDA 于 6 月 27 日公布了两份综合审评文件样本并公开征求意见。...
|

|
英国议会与患者组织呼吁严惩不披露临床试验数据者
2019.08.28
英国下议院科学技术委员会主席 Norman Lamb 再次呼吁英国卫生研究局(HRA)惩治不遵守临床试验报告要求的申办者和研究者。
上周,12 个患者权益倡导组织联名向 Lamb 发信,呼吁 Lamb 向 HRA 写一封公开信,提醒 HRA 有关议会对于不遵守临床试验报告要求的惩治期望,并鼓励 H...
|